Propiedades físicas de los hidrocarburos.
3. El petróleo y el gas son las principales materias primas energéticas.
3.1. Composición química del aceite.
El aceite es una mezcla. gran número varios hidrocarburos (HC) de la serie parafina (fórmula molecular C n H 2n+2), nafténicos y aromáticos (C n H 2n-2, -4, -6). El contenido de carbono oscila entre 82÷87%, hidrógeno 11÷14%. Estos dos componentes representan hasta el 99% de la composición total. Entre los hidrocarburos de diversas estructuras, suelen predominar los hidrocarburos de la serie del metano (parafina) y, con menos frecuencia, de la serie nafténica. Generalmente en condiciones normales (es decir, a una presión P = 0,1 MPa y una temperatura de 0 0 C (273 0 K) () Aceite Es un líquido aceitoso inflamable, generalmente de color marrón oscuro con un tinte verdoso. En la naturaleza, los aceites también se encuentran en colores más claros: marrón claro, rojizo, verde e incluso incoloros. La explicación a tanta variedad de aceites la encontramos en su complejísima composición, aunque en cuanto a su composición elemental son todos bastante similares
Los hidrocarburos de metano a butano (CH 4 ÷ C 4 H 10) de la serie de parafinas en condiciones normales se encuentran en estado gaseoso. Los hidrocarburos que contienen de 5 a 17 átomos de carbono por molécula (C 5 H 12÷ C 17 H 36) son sustancias líquidas en condiciones normales. Los hidrocarburos con más de 17 átomos de carbono por molécula son sólidos. Estos incluyen parafina y ceresina.
En condiciones de yacimiento, el petróleo consta de tres partes. En la superficie pierde gas y parcialmente parafina. El gas liberado del petróleo durante la producción suele denominarse asociado o petróleo.
Dependiendo de la composición y algunas propiedades, se clasifica el aceite, lo que facilita su clasificación por calidad y la elección de uno u otro esquema tecnológico de recogida. Por contenido de parafina Los aceites se dividen en:
· bajo en parafina (≤ 1,5%);
· parafina (1,5÷6%);
· altamente parafínico (>6%).
A veces se encuentran aceites con un alto contenido de parafina (hasta un 30%), por ejemplo, aceites de los campos de Uzen y Zhetybai. En condiciones normales se trata de sólidos. Los aceites de los yacimientos del norte de la región de Tyumen contienen hasta un 20% de parafina.
Los compuestos de azufre generalmente se consideran impurezas dañinas en el petróleo, ya que corroen directamente el metal o se convierten en compuestos corrosivos durante los procesos de refinación. Por contenido de azufre Los aceites se dividen en tres clases:
· bajo contenido de azufre (con un contenido de azufre de hasta el 0,5%);
· sulfuroso (0,5÷2%);
· alto contenido de azufre (más del 2%).
El azufre puede estar presente en el aceite tanto en estado libre como en forma de compuestos orgánicos (sulfuros, mercaptanos, etc.). El oxígeno suele estar presente en forma de ácidos nafténicos y grasos, así como de asfaltenos. Además de estos compuestos, los aceites contienen cantidades muy pequeñas de cloro, yodo, fósforo, arsénico, potasio, sodio, nitrógeno y muchos otros elementos de la tabla D.I. Mendeleev, así como agua de formación.
Se sabe que los hidrocarburos puros son incoloros e inodoros. Algunos expertos creen que el color del aceite proviene de la resina. Un 0,1% es suficiente para dar a los hidrocarburos puros un tono amarillo pajizo. El olor específico del aceite suele ser causado por el sulfuro de hidrógeno (H 2 S).
3.2. Propiedades físicas de los hidrocarburos.
Propiedades físicas del petróleo y los gases de petróleo, así como sus característica de calidad Dependen del predominio de los hidrocarburos individuales o de sus diversos grupos (fracciones). Las propiedades físicas del petróleo están determinadas por las propiedades de sus componentes (Tabla 2.6). Los aceites que contienen una cantidad significativa de hidrocarburos pesados dan menores rendimientos de fracciones de gasolina y tienen una mayor densidad.
Tabla 2.6
Propiedades de los componentes que componen los gases y el petróleo del petróleo.
Bajo densidad Se acostumbra entender la relación entre la masa de una sustancia a una temperatura de 20 0 C y el volumen ocupado. En el sistema SI, la densidad se mide en kg/m 3 y la gravedad específica γ se mide en N/m 3. En la práctica también utilizan densidad relativa, que es numéricamente igual a la relación entre la densidad del petróleo y la densidad del agua destilada a una temperatura de 4 0 C. Normalmente, el petróleo es más ligero que el agua, su densidad oscila entre 750÷950 kg/m 3. El petróleo con una densidad inferior a 900 kg/m 3 suele denominarse luz, y más de 900 kg/m 3 - pesado.
Cabe señalar que la densidad del petróleo disminuye al aumentar la temperatura y aumentar el contenido de gas en él. Por lo tanto, el petróleo del yacimiento saturado de gas siempre tiene una densidad menor que el petróleo desgasificado, y la diferencia es mayor cuanto más gas se extrae. Para determinar la densidad se utilizan hidrómetros (densímetros), picnómetros e instrumentos especiales (balanzas de Westphal, etc.).
Una de las principales propiedades físicas del petróleo, que tiene gran valor durante el diseño y operación sistemas de transporte, es la viscosidad. BajoviscosidadGeneralmente se acepta entender la propiedad del aceite de resistir el movimiento de partículas entre sí, es decir, Caracteriza la movilidad de un líquido.
Hay diferentes viscosidades dinámica µ, medido en [Pa s] y viscosidad cinemático ν, [m 2 /s]. La viscosidad del petróleo suele ser inferior a 1 Pa s, por lo que en la práctica suelen utilizar unidades fraccionarias, por ejemplo MPa s, o una unidad de viscosidad fuera del sistema llamada Stokes (1St = 10 -4 m 2 / s). La viscosidad cinemática se puede determinar mediante la relación entre la viscosidad dinámica del aceite y su densidad, es decir, ν=μ/ρ.
Al aumentar la temperatura, la viscosidad del aceite disminuye y, al aumentar la presión, por el contrario, aumenta. Los hidrocarburos de alto peso molecular aumentan el valor de la viscosidad, por lo que la viscosidad de los petróleos ligeros es menor que la de los petróleos pesados. La viscosidad del petróleo del yacimiento puede ser significativamente menor que la viscosidad del petróleo desgasificado. Por ejemplo, esta diferencia para el petróleo Romashkinskaya es de hasta el 600%.
Para medir la viscosidad del aceite, se utilizan instrumentos especiales: viscosímetros de tipo capilar y rotacional. En el primer caso, la viscosidad se define como la relación entre el tiempo de flujo del aceite de prueba a través del orificio de calibración y el tiempo de flujo de agua. Los viscosímetros rotacionales se basan en medir la resistencia durante la rotación relativa de dos cilindros coaxiales, cuyo espacio se llena con el aceite que se está probando.
En condiciones de yacimiento, siempre hay una cierta cantidad de gas disuelta en petróleo, a veces incluso hasta 1000 m. 3 /t (en promedio unos 100 m 3 /T). La capacidad del gas para disolverse en petróleo se caracteriza por el valor.coeficiente de solubilidad o factor de gas,que se entiende como la cantidad de gas (disuelto o liberado) reducida a la presión atmosférica por 1 tonelada de petróleo.
Componentes gas de petróleo tienen diferente solubilidad en aceite. Al aumentar el peso molecular, aumenta el coeficiente de solubilidad de los gases. Así, la solubilidad del etano es casi 5 veces mayor que la del metano y la del propano, más de 20 veces. A medida que aumenta la temperatura, la solubilidad disminuye.
En la práctica, a menudo no se encuentran con la solubilidad de los gases, sino con el fenómeno opuesto: la liberación de gas del petróleo. La presión a la que comienzan a desprenderse las primeras burbujas de gas disuelto se llama presión de saturación Rnorte. La presión de saturación caracteriza el equilibrio termodinámico del gas con el petróleo del yacimiento. El petróleo que se encuentra en el yacimiento a una presión superior a la presión de saturación generalmente se denomina subsaturado. La presión Pn depende tanto de los gases de hidrocarburos como de los gases que no son hidrocarburos, por ejemplo, el nitrógeno, que tiene la menor solubilidad en el petróleo. En el caso de que la presión en la formación sea inferior a Pn, no todo el gas se disolverá en el petróleo y parte del mismo ocupará áreas elevadas de la formación, formando una capa de gas.
La liberación de gas disuelto del petróleo también ocurre a medida que avanza a lo largo del pozo, en los oleoductos y gasoductos, y finalmente se completa en las etapas finales de separación después de la preparación del petróleo comercial.
La presión de saturación no debe identificarse con la presión de vapor saturado del petróleo comercial, en la cual las fases gaseosa y líquida del petróleo están en equilibrio termodinámico en una relación de fases fija. Normalmente esta presión no supera los 500 mm Hg.
3.3. Estados de fase de sistemas de hidrocarburos con cambios de presión y temperatura.
Los gases individuales o los sistemas multicomponentes pueden estar en estados monofásicos, bifásicos o trifásicos (gaseosos, líquidos o sólidos). Los gases individuales cambian su volumen dependiendo de la presión y la temperatura. Si una sustancia se encuentra en un estado monofásico, entonces su volumen V está determinado por la temperatura T y la presión P.
Durante la compresión isotérmica del metano, su volumen disminuye al aumentar la presión hasta que aparece la fase líquida (curva E). Luego, el metano se comprime a presión constante hasta que se transforma completamente en estado líquido, después de lo cual una mayor compresión provoca un fuerte aumento de presión (ba). La temperatura a la que aparece la primera gota de líquido en un gas al aumentar la presión se denomina punto de rocío o punto de condensación (punto d). La temperatura a la que ocurre. transición completa gas en líquido se llama punto de saturación (punto b). Línea B: la línea de coexistencia de equilibrio de las fases gaseosa y líquida, se llama línea de elasticidad del vapor, y la presión correspondiente es la presión de elasticidad del vapor.
Para sistemas de un componente, el punto de rocío, el punto de saturación y la presión de vapor corresponden a la misma presión y temperatura, por lo que la línea es paralela al eje de volumen específico. De esta figura se deduce que la línea bc es el lugar geométrico de los puntos de saturación y la línea cde es el lugar geométrico de los puntos de rocío. El punto C en el que se encuentran estas líneas se llama crítico. En este punto desaparece la distinción entre las fases gaseosa y líquida. El punto crítico C corresponde a la presión y temperatura críticas.
De este modo, temperatura máxima, a la cual un gas dado todavía puede convertirse en estado líquido, se llama temperatura crítica, y la presión correspondiente se llama presión crítica. Temperatura crítica el metano es -82,1 0 C, el etano - +32,3 0 C, el nitrógeno - +141,7 0 C. Dentro de la región bcde coexisten fases gaseosas y líquidas. A la derecha de la línea cde está la fase gaseosa, a la izquierda de la línea bc está la fase líquida.
El comportamiento de fases de los sistemas de dos y varios componentes depende no sólo de la presión y la temperatura, sino también de la composición del gas.
3.4. Composición y propiedades físicas de los gases naturales.
Depósitos gas natural Dependiendo de la composición de los productos del yacimiento, se dividen convencionalmente en gas y condensado de gas.
Gas- estos son depósitos cuyos productos no requieren procesamiento adicional antes de ser suministrado a los principales gasoductos. La preparación en este caso consiste únicamente en extraer la humedad del gas y, si es necesario, los componentes ácidos.
Condensado de gas- Se trata de depósitos cuyos productos deben procesarse para extraer de ellos pentano e hidrocarburos superiores. Esto afecta tanto al esquema de procesamiento de productos del yacimiento como a los indicadores técnicos y económicos de la operación del campo.
Las propiedades de un gas están determinadas por las propiedades. componentes individuales, incluido en su composición (Tabla 2.7).
El principal componente de los gases naturales es el metano (hasta un 98%). Los gases naturales también contienen cantidades importantes de etano, propano, butano, pentano e hidrocarburos más pesados. La composición de los gases siempre incluye vapor de agua y, con bastante frecuencia, componentes como nitrógeno, sulfuro de hidrógeno, dióxido de carbono y helio.
Tabla 2.7
fisico basico propiedades quimicas componentes incluidos en gases licuados a una temperatura de 0 0 C y una presión de 0,1013 MPa


En la composición de los gases naturales y el condensado de gas (Tabla 2.8), junto con el sulfuro de hidrógeno, también se encuentran otros compuestos de azufre, que se dividen en dos grupos: activos e inactivos. Los compuestos de azufre activos incluyen sulfuro de hidrógeno, azufre elemental, dióxido de azufre, mercaptanos, etc. Los compuestos de azufre inactivos incluyen sulfuros, disulfuros, tiofeno y tiofanos. De los compuestos de azufre del gas, el sulfuro de hidrógeno es el más activo; provoca la corrosión de los metales con formación de sulfuros; La presencia de humedad en el gas aumenta drásticamente el efecto corrosivo del sulfuro de hidrógeno y otros componentes ácidos.
Tabla 2.8
Composición de los condensados de gas de algunos campos.

El metano en condiciones normales (a P = 0,1 MPa y T = 20 0 C) se comporta como un gas real. El etano se encuentra en la frontera entre el gas y el vapor. El propano y los butanos son gases en condiciones normales, ya que sus parámetros críticos son muy elevados.
Los hidrocarburos, a partir del isopentano y superiores, en condiciones normales (0,1 MPa y 0 0 C) se encuentran en estado líquido y en la composición del gas se encuentran en forma de gotitas. La composición de los gases de los yacimientos de gas puro contiene mucho más metano que la de los gases de petróleo.
Dependiendo del predominio de componentes ligeros (CH 4, C 2 H 8) o pesados (C 3 H 8 + b), el gas se divide en dos grupos, respectivamente: seco y graso. En el gas seco, el contenido de hidrocarburos pesados es insignificante o ausente, mientras que en el gas húmedo su cantidad puede alcanzar valores tales que de él se pueden obtener gases licuados o condensado (gasolina). En la práctica, se acepta que el gas seco contiene menos de 60 g de gasolina por metro cúbico y más de 60 a 70 g de gasolina por metro cúbico como gas graso.
3.5. Hidratos de gas
Los hidratos de gas se descubrieron por casualidad. Según todos los cálculos de geólogos y expertos en permafrost, debería haber gas en las profundidades. Pero cuando perforaron el pozo, él no estaba. Los instrumentos descubrieron que en las profundidades se encuentran algunas rocas ligeramente porosas. Tomaron una muestra del pozo y la llevaron a habitación cálida, y luego... hubo una explosión.
El descubrimiento de los hidratos de gas se considera ahora casi una revolución energética. Sus reservas son simplemente increíbles: se encuentran bajo un tercio de la superficie terrestre y casi toda la superficie del Océano Mundial. Según cálculos preliminares, se trata simplemente de un yacimiento de gas supergigante. En Rusia, los depósitos de hidratos de gas ocupan una superficie de 2,4 millones de km 2, principalmente en el noroeste de la parte europea de Rusia, en Siberia y el Lejano Oriente.
Los hidratos de gas aparecen como cristales blanquecinos. Básicamente, se trata de agua congelada que ha absorbido una gran cantidad de hidrocarburos. Su capacidad energética es bastante alta: una metro cúbico El hidrato cristalino incluye hasta 200 m 3 de gas inflamable, por ejemplo metano.
En tierra, las reservas de los depósitos de hidratos de gas son inferiores a las reservas de gas convencionales. Y en los sedimentos marinos y las rocas subyacentes, ya a decenas y cientos de metros de profundidad, sus recursos son fácilmente accesibles. Se propone extraer hidratos de gases marinos mediante el levantamiento de la pulpa durante su posterior desgasificación. Esto requerirá macroplataformas y embarcaciones especiales equipadas con tuberías.
Para saber dónde buscar hidratos de gas, es necesario comprender cómo se formaron. Resultó que estos misteriosos gases invisibles (gases inflamables, por ejemplo, metano) se encuentran a varias decenas de metros por debajo de la sección de hielo. Cuando el agua se congela, captura aire y se hunde en la masa de hielo o, como dicen los glaciólogos, se extiende desde el centro hacia la periferia junto con las capas glaciales. Y bajo alta presión, a temperaturas negativas y con la ayuda de la fuerza motriz de la polarización, estos fluidos ya se transforman en hidratos. En la Antártida, esta transformación se produce a profundidades de más de 700 metros, y en Groenlandia, a partir de 900 metros. Así, en el espesor del hielo e incluso en las rocas subyacentes se acumulan sustancias volátiles, pero congeladas y endurecidas. Y se mueven según el avance o retroceso del glaciar. Cuando cambian los volúmenes de hielo y, por lo tanto, la presión, los fluidos también pueden desplazarse verticalmente. Las zonas marginales de los glaciares en las que fueron expulsados estos hidrocarburos se consideran prometedoras para la exploración de hidratos de gas.
Después del descubrimiento de hidratos de gas en hielo y estratos congelados y la comprensión de su enorme valor energético, las rocas congeladas comenzaron a ser llamadas "mina de oro". Pero resultó que esto no es sólo una comparación figurativa, sino un fenómeno muy real. En condiciones de permafrost se acumulan diversas sustancias que actúan como agentes oxidantes o reductores. Incluso un metal tan inerte como el oro puede acumularse en el hielo. Al derretirse " hielo en cuña", que se forman cuando el agua se congela en las grietas del suelo helado, a menudo aparecían ante los ojos de los investigadores del Norte estructuras caladas hechas de hilos y películas de oro. El "esqueleto" mineral puede contener otros minerales. Su búsqueda y exploración de yacimientos, junto con los de hidrocarburos, pertenece al ámbito de una ciencia que ya no es joven: la geoquímica de la zona de permafrost.
3.6 . Requisitos para la calidad del gas comercial.
Los indicadores de calidad del gas comercial se basan en los siguientes requisitos:
1. Durante el transporte, el gas no debe provocar corrosión en tuberías, accesorios, instrumentos, etc.;
2. La calidad del gas deberá garantizar su transporte en estado monofásico, es decir no debe ocurrir la formación y precipitación de hidrocarburos líquidos, condensados de agua e hidratos de gas en el gasoducto;
3. El gas comercial no debe causar complicaciones al consumidor a la hora de utilizarlo.
Para que el gas cumpla estos requisitos, es necesario determinar el punto de rocío del agua, el contenido de hidrocarburos, el contenido de compuestos de azufre, las impurezas mecánicas y el oxígeno del gas.
Un indicador importante de la calidad del gas comercial es su contenido de oxígeno. El valor de este indicador no supera el 1%. Con un mayor contenido de oxígeno, el gas se vuelve explosivo. Además, el oxígeno aumenta la corrosión en el sistema.
El estándar de la industria no especifica el contenido específico de hidrocarburos individuales en el gas de venta. Esto se debe a la diversidad de composiciones de los gases de alimentación (Tabla 2.9).
Tabla 2.9
Normas GOST 51.40-93 para gas natural transportado a través de gasoductos

GOST 51.40-93 introdujo un nuevo indicador que limita el contenido de azufre mercaptano en el gas comercial a no más de 36 mg/m 3 .
El gas también puede contener sulfuro de carbono (COS), disulfuro de carbono (CS 2), etc. GOST no indica el contenido de estos componentes. Sería necesario establecer la cantidad total de todos los compuestos de azufre en el gas.
Sin lugar a dudas, para garantizar un transporte, almacenamiento y uso confiable de los productos de la industria del gas, es necesario cumplir con ciertos requisitos establecidos en las normas y especificaciones técnicas pertinentes.
Por ejemplo, en etapa final desarrollo de campos de gas condensado para obtener gas comercial que cumpla con los requisitos del estándar de la industria, es necesario introducir unidades de refrigeración artificial (ARI). Los costos de construcción y operación de la planta de tratamiento de gas exceden significativamente el beneficio de la producción de productos adicionales de la planta de tratamiento de gas. Para mantener una alta eficiencia de los sistemas de transmisión de gas, se propone enfoque integrado para determinar indicadores de calidad del gas. La esencia de la propuesta se reduce a no implementar GOST en cada campo conectado a un gasoducto principal, sino en el campo principal para establecer indicadores de calidad del gas más altos que el estándar. El yacimiento más grande del grupo considerado puede considerarse el principal, por lo que sería económicamente rentable utilizar en él una tecnología compleja que permita secar el gas por humedad y extraer hidrocarburos pesados en todas las etapas de desarrollo.
Los campos base pueden ser aquellos cuyo gas contiene sulfuro de hidrógeno, porque En las plantas de procesamiento de gas, después de la desulfuración, es necesario secar en unidades de glicol o enfriar todo el volumen de gas mediante refrigeración artificial.
Casi sin grandes costos adicionales, es posible preparar gas en campos base o en plantas de procesamiento de gas con un punto de rocío para humedad e hidrocarburos más bajo que según GOST 51.40-83. Esto permitirá que el gas producido en pequeños campos ubicados a lo largo de la ruta se suministre al gasoducto principal sin organizar sistemas complejos tratamiento de gas de campo, realizando únicamente separación de fases líquidas. Mezclar gas crudo con gas que tiene un punto de rocío más bajo que según los requisitos de GOST permite obtener una mezcla que cumplirá con los requisitos de GOST.
El uso de un sistema de tratamiento de gas de campo de este tipo permite concentrar equipos de campo complejos en un campo base y desarrollar campos pequeños utilizando esquemas simplificados.
Requisitos básicos para procesos tecnológicos El procesamiento en campo y en fábrica de gases naturales y de petróleo garantiza los indicadores de calidad del gas comercial y otros productos de la industria del gas.
Cabe señalar que actualmente existen estándares internacionales uniformes para los contenidos permitidos de sulfuro de hidrógeno, dióxido de carbono, compuestos organosulfurados, nitrógeno, agua, impurezas mecánicas, etc. no existe.
3.7. Propiedades térmicas de los productos petrolíferos y del gas.
Calor de vaporización- la cantidad de calor gastado en convertir un kilogramo de líquido en vapor en su punto de ebullición (también se llama calor latente, porque no se gasta en aumentar la temperatura del producto, sino en su evaporación).
Valores medios de calor de evaporación (en kJ/kg): gasolina - 293÷314; queroseno - 230÷251; combustibles diesel - 209÷213; aceites - 167÷209.
El calor de evaporación de las fracciones de aceite se puede determinar mediante la siguiente fórmula:
l = 4,19∙(22T a /μ), kJ/kg
donde μ es el peso molecular;
Tk - temperatura promedio hirviendo, k.
Calor de condensación- la cantidad de calor liberado cuando el vapor se condensa en líquido a la misma temperatura y es numéricamente igual al calor latente de evaporación.
Calor de combustión(poder calorífico) - la cantidad de calor liberado durante la combustión completa del combustible, kJ/kg (petróleo - 42∙10 3, fueloil - 41∙10 3, carbón - 31∙10 3, acetileno - 49∙10 3, metilo alcohol - 22 ∙10 3, etano - 52∙10 3, butano - 57∙10 3).
Calor de fusión(latente): la cantidad de calor absorbida por 1 kg de un sólido cuando se convierte en líquido en su punto de fusión.
Punto de fluidez- la temperatura a la que el producto pierde su fluidez. Con un aumento en el contenido de hidrocarburos pesados en un producto petrolífero, el punto de fluidez disminuye. Esta característica es indicador importante para aceites.
Temperatura de cristalización- la temperatura a la que comienza la precipitación de hidrocarburos (principalmente parafina), acompañada de turbidez del producto petrolífero y un cambio en sus características de viscosidad.
Conociendo las dos últimas características, podrá elegir mejor métodos para almacenar y transportar productos con un punto de fluidez bajo.
Punto de ebullición- la temperatura a la que una sustancia pasa del estado líquido al estado de vapor, no solo desde la superficie de la sustancia (como durante la evaporación), sino en todo el volumen.
Capacidad calorífica- la cantidad de calor que se debe gastar para calentar 1 kg de una sustancia a 1 0 C. Dependiendo de la cantidad de producto al que se refiere el calor, se distinguen específico (por unidad de masa) y molar (por mol). Conociendo la capacidad calorífica del producto, se puede determinar la cantidad de calor necesaria para calentarlo a la temperatura requerida. La capacidad calorífica aumenta al aumentar la temperatura y disminuir la densidad. Dependiendo de las condiciones en las que se produce el proceso para gases y vapores, se distingue la capacidad calorífica a presión constante (C p) y a volumen constante (C v). También se hace una distinción entre la capacidad calorífica real (a una temperatura determinada). La capacidad calorífica media ponderada de la mezcla C cm se determina según la ley de aditividad.
Para la gasolina, la capacidad calorífica cambia de 1,93 a 2,21 kJ/kg∙K cuando la temperatura cambia de 0 0 C a 50 0 C. Para el combustible para aviones, de 1,91 a 2,15 kJ/∙kgK. Para etano - 3,3, propano - 2,2.
Contenido de humedad de los gases naturales. El gas natural en condiciones de yacimiento está saturado con vapor de agua, ya que las rocas que contienen gas siempre contienen agua ligada, del fondo o marginal. Durante la explotación de los campos los valores de presión y temperatura cambian. En este caso, una disminución de la temperatura provoca una disminución de la cantidad de vapor de agua en la fase gaseosa y una disminución de la presión provoca un aumento de su contenido. En el yacimiento mismo, a medida que avanza el desarrollo, el contenido de humedad del gas aumenta, porque La presión del yacimiento cae en condiciones isotérmicas. Contenido de humedad del gas natural - el parámetro más importante, que determina en gran medida modos tecnológicos operación de pozos de instalaciones de producción de gas.
El contenido de humedad absoluta W es igual a la masa de vapor de agua por unidad de volumen de la mezcla de gases, reducida a condiciones normales (0 0 C y 0,1 MPa), y se mide en g/m 3 o kg/1000 m 3.
El contenido de humedad relativa W 0 es la relación entre el contenido real de vapor de agua por unidad de volumen de una mezcla de gases a una presión y temperatura determinadas y su contenido de humedad, es decir, a la cantidad de vapor de agua que podría contener el mismo volumen y en las mismas condiciones en plena saturación. W 0 se mide en fracciones de unidad o %. La saturación total se estima en 100%.
Hidratos cristalinos de gases naturales.. Muchos componentes del gas natural (metano, etano, propano, isobutano, dióxido de carbono, sulfuro de hidrógeno, nitrógeno) cuando se combinan con agua forman hidratos cristalinos: compuestos cristalinos sólidos que existen en altas presiones y temperaturas positivas. ellos representan conexiones fisicas gas y agua (clatratos), que se forman cuando las moléculas de gas se introducen en los huecos de estructuras cristalinas compuestas de moléculas de agua. Todos los gases cuyo tamaño molecular está en el rango (4÷6,9)∙10 -9 m forman hidratos.
Las condiciones para la formación de hidratos de gas se pueden representar mediante curvas de equilibrio de formación de hidratos en coordenadas temperatura – presión para diferentes densidades.
Al aumentar la presión y la densidad del gas, aumenta la temperatura de formación de hidratos. Las áreas de existencia de hidratos en estos gráficos se ubican a la izquierda y encima de las curvas.
3.8. Propiedades peligrosas de los gases naturales y el petróleo.
Las propiedades peligrosas de los gases de hidrocarburos son sus Toxicidad y capacidad de formar mezclas explosivas. con aire, encendido por una chispa eléctrica, llama, etc.
Con un aumento en el peso molecular de los hidrocarburos limitantes, aumentan sus propiedades tóxicas. La concentración máxima permitida para el metano es de 10 mg/dm 3 y para el heptano sólo 2 mg/dm 3.
Normas sanitarias diseño de empresas industriales en área de trabajo Las instalaciones de producción cuentan con una concentración máxima permitida (MPC) de hidrocarburos (vapores de gasolina) igual a 0,3 mg/dm 3 .
De los componentes gaseosos de los gases naturales y del petróleo, el sulfuro de hidrógeno es especialmente tóxico. El sulfuro de hidrógeno es un gas incoloro. Densidad relativa su tasa en el aire es 1,19. Una persona siente el sulfuro de hidrógeno (olor a huevos podridos) incluso cuando su contenido en el aire es de 0,0014÷0,0023 mg/dm3. Sin embargo, incluso con una breve estancia de una persona en un ambiente de sulfuro de hidrógeno, su sentido del olfato se embota. El sulfuro de hidrógeno es un veneno que provoca parálisis de los órganos respiratorios y del corazón (Tabla 2.10).
Tabla 2.10
Concentración máxima permitida, mg/l
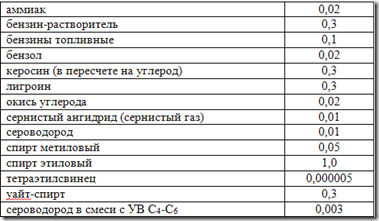
Los gases naturales del petróleo de muchos yacimientos contienen sulfuro de hidrógeno (H 2 S) y dióxido de carbono (CO 2). El contenido en volumen de estos componentes, a veces llamados ácidos, varía ampliamente y alcanza el 50% o más. Se encontraron contenidos significativos de H 2 S y CO 2 en los gases de los depósitos profundos de la cuenca del Caspio y, en particular, en Oremburgo, Karachaganak y Astracán. El contenido de componentes ácidos en el gas del campo de Astracán alcanza el 40%, de los cuales la concentración de sulfuro de hidrógeno es del 22%.
El impacto de los gases en el cuerpo humano es siempre negativo (Tabla 2.11).
Tabla 2.11
Efectos fisiológicos de los gases en el cuerpo humano.
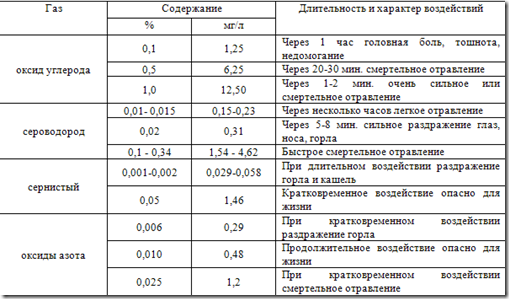
Una concentración de sulfuro de hidrógeno de 0,006 mg/dm3 durante una respiración de 4 horas provoca dolor de cabeza, lagrimeo, fotofobia y secreción nasal. A una concentración de aproximadamente 0,2÷0,28 mg/dm 3, se observa sensación de ardor en los ojos, fotofobia, lagrimeo, irritación en la nariz y faringe, sabor metálico en la boca y náuseas. Una concentración de sulfuro de hidrógeno de 1 mg/dm3 o superior provoca una intoxicación aguda (convulsiones, pérdida del conocimiento y muerte rápida). La concentración máxima permitida de sulfuro de hidrógeno en el área de trabajo de las instalaciones de producción es de 0,01 mg/dm 3 .
El dióxido de carbono es incoloro y prácticamente inodoro. Carácter general Efectos en el organismo: narcóticos e irritantes para la piel y las membranas mucosas. En altas concentraciones provoca una rápida asfixia por falta de oxígeno.
El gas licuado de petróleo (GLP) es una mezcla compleja de hidrocarburos que, en condiciones normales, se encuentran en estado gaseoso. Tres de sus marcas se producen y comercializan para necesidades municipales y domésticas:
SPBTZ – mezcla técnica de invierno de propano y butano;
SPBTL – mezcla técnica de verano de propano y butano;
BT – butano técnico.
La composición del GLP incluye hidrocarburos con el número de átomos de hidrocarburo en la molécula C2-C5: etano, propano, butano y pentano.
El etano (C2H6) es un gas en condiciones normales (temperatura 273,16 K (0°C), presión 98066,5 Pa) con una densidad de 1,36 kg/m3. El etano se añade al gas licuado en pequeñas cantidades, ya que a 318 K (45 °C) no puede permanecer en estado licuado, y a 303 K (30 °C) su presión de vapor saturado alcanza los 4,8 MPa. Estas propiedades deben tenerse en cuenta porque los cilindros de almacenamiento soldados de acero gas licuado están diseñados para una presión de trabajo de 1,6 MPa y tanques subterráneos, 1 MPa.
Se introduce etano en propano para aumentar la presión de vapor saturado total de la mezcla de gases, para evitar una disminución de la presión del gas en invierno.
Componentes de hidrocarburos del gas licuado.
Propano (C3 H8) - gas pesado, teniendo una densidad en condiciones normales igual a 2,02 kg/m3. Este es uno de los componentes principales del gas licuado. Se supone que la temperatura máxima de diseño a la que la presión de vapor de propano saturado es de 1,6 MPa es 318 K (45 °C). Esto cumple con los requisitos de GOST 15860-84 para cilindros de acero para gases de hidrocarburos licuados. La presión de vapor de propano a una temperatura de 238 K (-35 °C) es de 0,14 MPa, el valor más bajo al que el regulador de presión proporciona el rendimiento mínimo permitido de una instalación grupal. Por tanto, el propano en estado licuado se puede utilizar como combustible sin regasificación artificial a temperaturas de hasta 243 K (-30 ° C)
La fase de vapor del propano técnico a temperaturas inferiores a 231 K (-42 °C) se condensa en un gasoducto de baja presión, lo que en última instancia puede provocar la interrupción del suministro de gas.
El butano (C4H10) es un gas pesado que tiene dos isómeros: butano e isobutano. teniendo lo mismo composición química y peso molecular, difieren en la disposición de los átomos en la molécula. Los isómeros del butano son líquidos de bajo punto de ebullición. La densidad de la fase vapor del butano técnico en condiciones normales oscila entre 2,67 y 2,70 kg/m3 y comienza a condensarse a una temperatura de 272,5 K (-1 °C). En este sentido, el gas licuado con alto contenido en butano, cuando se utiliza con fines domésticos en invierno, está sujeto a regasificación artificial.
El butano técnico se puede utilizar a temperaturas atmosféricas no inferiores a 278 K (5 °C). Aumentar la cantidad de butano en el gas licuado permite, sin violar los requisitos de presión máxima de vapor saturado, aumentar el contenido de componentes ligeros: metano, etano y etileno.
El pentano (C5 H12) es un gas pesado con una densidad en condiciones normales de 3,22 kg/m3. Su presencia en gas licuado reduce drásticamente la presión de vapor, aumenta el punto de rocío y aumenta la masa del residuo líquido. La temperatura de condensación del pentano alcanza los 309 K (36 °C). Por lo tanto, en los gasoductos GRU equipados con evaporadores, es necesario instalar colectores de condensado, cuyo diseño debe garantizar la eliminación de los residuos líquidos.
Al diseñar y operar plantas de gas licuado, es necesario tener en cuenta las características físicas y químicas básicas no solo de los componentes individuales de los hidrocarburos, sino también de sus mezclas: como la presión de vapor saturado, la densidad, los parámetros críticos, el coeficiente de expansión y compresión volumétrica. , punto de rocío, calor específico de transformación de fase, capacidad calorífica.
En condiciones estándar (T = 298 K, P = 1 atm), dependiendo de la estructura y el peso molecular, los hidrocarburos pueden ser sustancias gaseosas, líquidas o sólidas. Todos los hidrocarburos con una longitud de cadena C 1 – C 4 son gaseosos, C 5 – C 16 son líquidos. Los hidrocarburos de composición C 19 y superiores son sólidos. El tipo de cadena de carbono afecta las temperaturas de ebullición (t 0 k) y de fusión (t 0 pl). Por tanto, los hidrocarburos normales, a diferencia de los isómeros ramificados, tienen t 0 k y t 0 pl más altos. Ejemplo:
CH3-CH2-CH2-CH2-CH3 CH3-CH(CH3)-CH2-CH3
n-pentano isopentano (2-metilbutano)
t 0 k = +36 0 С, t 0 pl = -130 0 С t 0 k = +28 0 С, t 0 pl = -160 0 С
Las fuerzas de Van der Waals actúan entre las moléculas de hidrocarburos en estado sólido y líquido. Las fuerzas surgen entre moléculas aromáticas - - interacción electrónica. Por tanto, la fuerza de adhesión entre moléculas es mayor para las cadenas de carbono normales en los hidrocarburos líquidos, y la separación de una molécula de la superficie del líquido es más difícil para las cadenas n que para las isoméricas ramificadas. En los hidrocarburos sólidos, la transición de fase sólida → líquida está determinada por la densidad de empaquetamiento de las moléculas. Este embalaje es más compacto para hidrocarburos no ramificados. Por tanto, los n-hidrocarburos se funden a una temperatura más alta que los ramificados. El empaquetado suelto de moléculas de hidrocarburos ramificados en la fase sólida provoca fuerzas de interacción intermoleculares más débiles y energías más bajas de la red cristalina.
La introducción de un doble enlace reduce ligeramente t 0 k (entre 5 y 7 0) en comparación con los alcanos. La dependencia t 0 pl es más compleja.
Los alcadienos conjugados se parecen a los alcanos en t 0 k, es decir, la conjugación no afecta el punto de ebullición. Por lo tanto, incluso la conjugación aromática en benceno (t 0 k = +80 0 C) no cambia t 0 k (t 0 k de ciclohexano +81 0 C). Con un aumento en el número de enlaces , y especialmente en el caso de su conjugación, las temperaturas de fusión de los hidrocarburos aumentan notablemente.
H 2 C=CH-CH 2 -CH 3 H 2 C=CH-CH=CH 2 HC C-C CH
1-buteno 1,3-butadieno 1,3-butadiina
t 0 pl = -185 0 C t 0 pl = -109 0 C t 0 pl = -36 0 C
Las arenas tienen, según el tipo, dependencias más complejas t 0 k y t 0 pl. Entre los isómeros del benceno disustituidos, los para-isómeros siempre tienen una t 0 pl más alta (se congelan más fácilmente). La introducción de un grupo alquilo en el benceno aumenta significativamente t 0 k (reduce la volatilidad) y reduce en gran medida t 0 pl.
Color, olor, efecto sobre la piel.
Casi todos los hidrocarburos son incoloros a excepción de los polienos conjugados de cadena larga. Ejemplo:
H 2 C=CH-(CH=CH-CH=CH)n -CH=CH2, con n = 2 o más aparece color (licopeno o caroteno de tomate). Los hidrocarburos aromáticos mononucleares son compuestos incoloros.
El olor de un compuesto orgánico está determinado por su volatilidad y la naturaleza de su interacción con los receptores de los órganos olfativos. Los hidrocarburos gaseosos (metano, etano, propano, butano) son inodoros. Todos los hidrocarburos gaseosos insaturados, empezando por el ligero olor del etileno, tienen un olor que se intensifica con el aumento del número de enlaces y con su conjugación. El acetileno tiene un ligero olor etéreo. Todos los hidrocarburos líquidos tienen olor a queroseno o gasolina. Los hidrocarburos sólidos no huelen cuando temperatura normal, si no son volátiles.
Los hidrocarburos líquidos son irritantes para la piel.
Densidad, estructura del estado líquido.
La mayoría de los hidrocarburos tienen una densidad (masa volumétrica) inferior a 1. La densidad de los hidrocarburos aumenta a medida que aumenta el peso molecular. Así, en la serie de alcanos de C 1 a C 30, la densidad aumenta de 0,415 a 0,810, en la serie de alquenos de C 3 a C 6 de 0,610 a 0,674, en la serie de alquinos de C 3 a C 10 de 0,690 a 0,766. Esto se debe a un aumento de las fuerzas de interacción intermolecular debido a la aparición de enlaces .
Como resultado de la interacción intermolecular - , los arenos están notablemente estructurados, a diferencia de los alcanos, alquenos y alquinos. Por tanto, su densidad es significativamente mayor que la de otros hidrocarburos (para el benceno d 4 · 20 = 0,879) y depende poco de la alquilación.
Nota: designación d 4 t significa que la densidad del líquido se mide a una temperatura relativa a la densidad del agua a 4 0 C.
Solubilidad en agua y disolventes no acuosos.
A la hora de disolver hidrocarburos en disolventes, el factor determinante es la solvatación de sus moléculas, ya que la estructura de los hidrocarburos líquidos y sólidos es baja. La solvatación debe entenderse como la suma total de cambios energéticos y estructurales que ocurren en un sistema durante la transición de moléculas, iones, radicales o átomos gaseosos a la fase líquida de un solvente con la formación de una solución homogénea que tiene una determinada composición química y estructura. La solvatación de moléculas orgánicas poco polares se lleva a cabo debido a interacciones dipolo-dipolo y de dispersión. Los hidrocarburos se solvatan bien con líquidos no polares y sus derivados halógenos, pero se solvatan mal con líquidos polares (agua, alcoholes, ácidos carboxílicos). Cuanto mayor es la polaridad del disolvente, menor es la solubilidad de los hidrocarburos. Por tanto, todos los hidrocarburos son infinitamente solubles entre sí y en derivados halógenos (dicloroetano, cloroformo, tetracloruro de carbono, cloruro de metileno, etc. Al mismo tiempo, son poco solubles en alcoholes, cetonas, ésteres y prácticamente insolubles en agua.
Inflamabilidad, explosividad, toxicidad.
La mayoría de los hidrocarburos son tóxicos si sus vapores se inhalan crónicamente. El benceno es especialmente peligroso cuando se trabaja con él durante mucho tiempo, así como los arenos condensados con más de 4 anillos de benceno. Estos últimos contribuyen al desarrollo de cáncer (sustancias cancerígenas), por lo que su liberación a la atmósfera y cuerpos de agua es inaceptable.
Todos los hidrocarburos son inflamables. Cuando se calienta a 400-6000C sin oxígeno, se produce carbonización, con oxígeno, se produce combustión.
Las propiedades fisicoquímicas y los indicadores de peligro de incendio están interconectados. Por lo tanto, un punto de ebullición bajo de una sustancia indica un punto de inflamación bajo de esta sustancia, y una actividad química alta, especialmente hacia los agentes oxidantes, indica una temperatura de ignición baja.
Así, en la serie de alcanos, a medida que aumenta la longitud de la cadena, aumenta el punto de ebullición y, en consecuencia, el punto de inflamación. La entalpía de combustión aumenta y la temperatura de autoignición disminuye.
Al quemar gas natural se alcanzan temperaturas de hasta 1000 0 C y superiores, y la combustión de acetileno en mezcla con oxígeno produce una llama con una temperatura de hasta 2800 0 C. Se utiliza para cortar y soldar metales.
De interés práctico es el cálculo de los calores estándar de combustión de hidrocarburos. Consideremos este tema usando los alcanos como ejemplo.
En la fórmula general, la ecuación para la reacción de combustión de alcanos se puede escribir de la siguiente manera:
C norte H 2n+2 + (3n+1)/2 O 2 = nCO 2 + (n+1)H 2 O
El calor estándar de combustión con Н 298 se puede calcular a partir de la diferencia entre los calores estándar de formación de productos de reacción y reactivos:
con Н 298 = muestra Н 298 (productos) - muestra Н 298 (reactivos).
Para el cálculo se pueden utilizar los valores arr H 298, dados, por ejemplo, en el “Chemist's Handbook”, 1966, T. 1, págs. 774 – 837, 854 – 875. A continuación se muestran los calores de formación a partir de C(tv), O 2 (gas), H 2 (gas), CO 2 gaseoso, agua líquida (en kJ/mol).
CO 2 (gas) muestra H 298 = -393,3,
H 2 O (l) arr H 298 = -285,8.
Los calores de formación de compuestos orgánicos se pueden calcular con una buena aproximación mediante los llamados incrementos. En este caso, parten del supuesto de que cada unidad estructural aporta siempre la misma contribución al calor de formación, independientemente del compuesto en el que se ubique esta unidad (el principio de aditividad). A continuación se muestra una tabla de 2 incrementos estructurales suficientes para calcular los calores de formación de alcanos.
Tabla 2
Valores de incremento estructural
Cálculo del poder calorífico estándar del propano.
CH 3 – CH 2 – CH 3 + 5O 2 3CO 2 + 4H 2 O
La suma de los calores de formación de productos es igual a:
3(-393,3) + 4(-285,8) = -2323,1 kJ/mol
Suma de calores de formación de reactivos:
(-42,34) 2 + (-20,63) = -105,31 kJ/mol
(El calor de formación de O 2 (gas) a partir de O 2 (gas) es naturalmente cero.
La diferencia da el poder calorífico estándar del propano:
s H 298 = -2323,1-(-105,3) = -2217,8 kJ/mol
Cuando se extrae carbón en las minas, a menudo se libera metano, formando mezclas explosivas con el aire. Cuando las mezclas de metano y aire explotan, la presión se desarrolla hasta 706 kPa. Por lo tanto, cuando pueda liberarse gas natural, es muy importante controlar la composición del aire. Para evitar una explosión en caso de una liberación de emergencia de metano y para extinguir una llamarada en volúmenes cerrados, se utiliza CO 2 o nitrógeno. La concentración mínima de dióxido de carbono como agente extintor de incendios es del 26% (vol.), nitrógeno del 39% (vol.). El metano forma una mezcla con cloro que explota cuando se expone a la luz solar u otra fuente de luz potente. También puede ocurrir una explosión de una mezcla de metano y cloro cuando se calienta a 150 0 C. Por lo tanto, es inaceptable almacenar cilindros con cloro y metano juntos.
Representante de alquenos - etileno capaz de combustión espontánea en una atmósfera de cloro. Esta reacción ocurre de manera explosiva, especialmente si la mezcla se expone a la luz solar. Por lo tanto, el almacenamiento combinado de cilindros de cloro y etileno es inaceptable. A diferencia del metano, el etileno arde con una llama muy luminosa, debido a su mayor contenido de carbono. Cuando se enciende, una mezcla de etileno y aire explota con gran fuerza. La presión alcanza los 764 kPa. La concentración mínima de dióxido de carbono como agente extintor de incendios en este caso es del 42% (vol.) y de nitrógeno del 52% (vol.). Estas concentraciones son mucho más altas que las del metano, debido al rango más amplio de límites de inflamabilidad del etileno.
Acetileno inestable bajo presión. A presiones superiores a 196 kPa, el acetileno puede descomponerse explosivamente en carbono e hidrógeno. La temperatura de explosión es de 3000 0 C, la presión aumenta aproximadamente 11 veces. Por tanto, el acetileno no se puede almacenar comprimido, como otros gases, en cilindros de acero convencionales. Para su almacenamiento y transporte se utilizan cilindros llenos de carbón activo impregnado de acetona, en los que se disuelve acetileno a presión. Con este método de almacenamiento, el acetileno no explota ni siquiera a una presión de 2940 kPa. El acetileno forma mezclas explosivas con el aire. Límites de inflamabilidad: LEL – 2%, ERW – 81%. La temperatura de autoignición es de 335 0 C. Las mezclas de acetileno y aire explotan con gran fuerza. La presión de explosión alcanza los 931 kPa. Para evitar una explosión durante una liberación de emergencia de acetileno y para extinguir una llamarada en espacios cerrados, se requiere CO 2 al 57% (vol.) y nitrógeno al 70% (vol.).
Aceite– fuente de hidrocarburos, líquido altamente inflamable. Su punto de inflamación oscila entre -34 0 C y +34 0 C. El aceite tiene una temperatura de autoignición relativamente baja, que oscila entre 260 y 375 K. Además, tiene un alto calor de combustión (por encima de 42 000 kJ/kg). Al destilar aceite se obtienen las siguientes fracciones:
La fracción gaseosa contiene alcanos C 1 – C 4. El gas natural es predominantemente metano ( 98%), el gas envasado es principalmente propano y butano.
La fracción de gasolina (t 0 k = 40 – 180 0 C) contiene hidrocarburos C 5 – C 12, en total hasta 100 o más compuestos individuales, incluidos alcanos, cicloalcanos y alquilbencenos.
La fracción de queroseno (t 0 k = 180 – 300 0 C) contiene principalmente hidrocarburos C 9 – C 16. Es un combustible para aviones y una materia prima para el craqueo.
El destilado solar (t 0 k = 300 – 400 0 C) se compone principalmente de hidrocarburos C 15 – C 25. Esta es la materia prima para producir combustible diesel.
El fueloil (t 0 k = 300 0 C en el vacío) tiene una composición aproximada de C 20 - C 30. Se utiliza como combustible para la combustión en hornos de calderas. La destilación fraccionada al vacío produce aceites lubricantes, vaselina y parafina.
hidrocarburo aromático benceno– un líquido inflamable que arde con una llama muy humeante. Cuando las mezclas de vapor y aire explotan, la presión se desarrolla hasta 784 kPa. Los hidrocarburos aromáticos se extinguen con agua finamente pulverizada y espuma.
La gran ventaja de las mezclas de propano-butano es su similitud en características básicas con los combustibles para motores tradicionales. Es esta cualidad la que les ha permitido tomar una posición sólida en el mercado.
Los hidrocarburos que componen el gas de petróleo asociado se encuentran en estado gaseoso en condiciones normales, pero con un aumento de la presión externa cambian su estado de agregación y se vuelven líquidos. Esta propiedad permite alcanzar altos densidad de energía y almacenar gas licuado de petróleo (GLP) en tanques de diseño relativamente simple.
A diferencia del gas de petróleo asociado, los hidrocarburos que componen el gas natural se encuentran en estado gaseoso en condiciones normales y no cambian su estado de agregación incluso con un cambio significativo de presión. Por lo tanto, el almacenamiento de gas natural comprimido (GNC) conlleva importantes dificultades; por ejemplo, el tanque debe soportar una presión significativa de hasta 200 atmósferas.
Se están promoviendo intensamente las tecnologías para la producción y el uso de gas natural licuado (GNL), que puede almacenarse en recipientes isotérmicos especiales a temperaturas inferiores a -160°C y una presión de aproximadamente 40 bar.
En muchos sentidos, los beneficios de la alta densidad energética del GNL se pierden debido a la complejidad de los equipos criogénicos, que son mucho más costosos y requieren un monitoreo constante por parte de personal altamente calificado.
producción de GLP
Los principales componentes del licuado. gas hidrocarburo son propano C 3 H 8 y butano C 4 H 10. Principalmente producción industrial El gas licuado se suministra de las siguientes fuentes:
- gases asociados al petróleo;
- fracciones condensadas de gas natural;
- gases de procesos de estabilización de petróleo y condensados;
- Gases de refinería obtenidos de plantas de refinación de petróleo.
Tabla 1. Parámetros fisicoquímicos del gas de hidrocarburo licuado según GOST 27578-87
| Indicador | Marca GSN | |
| Pensilvania | PBA | |
| Fracción de masa de componentes, %: | ||
| metano y etano | No estandarizado | |
| propano | 90±10 | 50±10 |
| hidrocarburos C 4 y superiores | No estandarizado | |
| hidrocarburos insaturados, (no más) | 6 | 6 |
| Volumen de residuo líquido a +40°С, % | Ausente | |
| Presión de vapor saturado, MPa: | ||
| a +45°C, no más | – | 1,6 |
| a -20°С, no menos | – | 0,07 |
| a -35°С, no menos | 0,07 | – |
| Fracción masiva de azufre y compuestos de azufre, %, no más | 0,01 | 0,01 |
| Incluyendo sulfuro de hidrógeno,%, no más | 0,003 | 0,003 |
| Contenido libre de agua y álcalis. | Ausente | |
La composición de los componentes del gas licuado está regulada por normas técnicas y. La primera norma describe la composición del gas licuado utilizado en el transporte por carretera. En el sitio web de la empresa Technosoyuz se presentan cabinas de pintura en una amplia gama, así como varios equipos para un servicio de auto. En invierno, se prescribe el uso de gas licuado de la marca PA (propano para automóviles), que contiene 85 ± 10% de propano, en verano, PBA (propano-butano para automóviles), que contiene 50 ± 10% de propano, butano y no más del 6% de hidrocarburos insaturados.
GOST 20448-90 tiene tolerancias más amplias para el contenido de componentes, incluidos los nocivos en términos de su impacto en los equipos de gas (por ejemplo, azufre y sus compuestos, hidrocarburos insaturados, etc.). Según estos especificaciones técnicas El gas combustible se presenta en dos grados: mezcla de propano y butano de invierno (SPBTZ) y mezcla de propano y butano de verano (SPBTL).
El grado de gas PBA está aprobado para su uso en todas las regiones climáticas a temperaturas ambiente no inferiores a -20 °C. La marca PA se utiliza en invierno en aquellas regiones climáticas donde la temperatura del aire desciende por debajo de -20°C (rango recomendado - -25...-20°C). En primavera, para agotar completamente las reservas de gas licuado de grado PA, se permite su uso a temperaturas de hasta 10°C.
Presión del cilindro
En un tanque cerrado, el GLP forma un sistema de dos fases. La presión en el cilindro depende de la presión del vapor saturado (presión de vapor en un volumen cerrado en presencia de la fase líquida) y caracteriza la volatilidad del gas licuado, que, a su vez, depende de la temperatura de la fase líquida y porcentaje propano y butano en él. La volatilidad del propano es mayor que la del butano, por lo que su presión a temperaturas negativas es mayor.
La experiencia de muchos años de funcionamiento práctico muestra:
- en bajas temperaturas aire ambiente, es más eficaz utilizar GLP con un alto contenido de propano, ya que esto garantiza una evaporación fiable del gas y, por tanto, un suministro estable del producto;
- a temperaturas ambiente altas y positivas, es más eficaz utilizar GLP con un contenido reducido de propano; de lo contrario, se creará un exceso de presión significativo en el tanque y las tuberías, lo que puede afectar negativamente la estanqueidad del sistema de gas.
Además de propano y butano, el GLP contiene una pequeña cantidad de metano, etano y otros hidrocarburos, que pueden cambiar las propiedades de la mezcla. Por lo tanto, el etano tiene una presión de vapor saturado más alta en comparación con el propano, lo que puede tener un impacto impacto negativo a temperaturas positivas.
Cambio en el volumen de la fase líquida al calentar.
La mezcla de propano-butano tiene un alto coeficiente de expansión volumétrica de la fase líquida, que para el propano es de 0,003 y para el butano de 0,002 por cada 1°C de aumento de la temperatura del gas. A modo de comparación: el coeficiente de expansión volumétrica del propano es 15 veces mayor y el del butano es 10 veces mayor que el del agua. Las normas y reglamentos técnicos establecen que el grado de llenado de tanques y cilindros depende del tipo de gas y de la diferencia de temperatura durante el llenado y durante el posterior almacenamiento. Para tanques cuya diferencia de temperatura no exceda los 40° C, se supone que el grado de llenado es del 85%; con una diferencia de temperatura mayor, el grado de llenado debe reducirse. Los cilindros se llenan por peso de acuerdo con las instrucciones de las "Reglas de diseño y operación segura recipientes que operan bajo presión." Máximo temperatura permitida El calentamiento del cilindro no debe exceder los 45°C, mientras que la presión de vapor del butano alcanza los 0,385 MPa y la del propano, de 1,4 a 1,5 MPa. Los cilindros deben protegerse del calentamiento. rayos de sol u otras fuentes de calor.
Cambio en el volumen de gas durante la evaporación.
Cuando se evapora 1 litro de gas licuado, se forman unos 250 litros de gas gaseoso. Por lo tanto, incluso una pequeña fuga de GLP puede ser muy peligrosa, ya que el volumen de gas durante la evaporación aumenta 250 veces. La densidad de la fase gaseosa es entre 1,5 y 2,0 veces mayor que la densidad del aire. Esto explica que cuando hay una fuga, el gas tiene dificultades para dispersarse en el aire, especialmente en interiores. Sus vapores pueden acumularse en depresiones naturales y artificiales, formando una mezcla explosiva.
Tabla 2. Propiedades fisicoquímicas componentes del gas licuado y la gasolina.
| Indicador | Propano | Butano (normal) | Gasolina |
| Peso molecular | 44,10 | 58,12 | 114,20 |
| Densidad de la fase líquida en condiciones normales, kg/m 3 | 510 | 580 | 720 |
| Densidad de la fase gaseosa, kg/m3: | |||
| en condiciones normales | 2,019 | 2,703 | – |
| a una temperatura de 15°C | 1,900 | 2,550 | – |
| Calor específico de evaporación, kJ/kg | 484,5 | 395,0 | 397,5 |
| Menor calor de combustión: | |||
| en estado líquido, MJ/l | 65,6 | 26,4 | 62,7 |
| en estado gaseoso, MJ/kg | 45,9 | 45,4 | 48,7 |
| en estado gaseoso, MJ/m 3 | 85,6 | 111,6 | 213,2 |
| Número de octano | 120 | 93 | 72-98 |
| Límites de inflamabilidad cuando se mezcla con aire en condiciones normales, % | 2,1–9,5 | 1,5–8,5 | 1,0–6,0 |
| Temperatura de autoignición, °C | 466 | 405 | 255–370 |
| Cantidad de aire teóricamente necesaria para la combustión de 1 m 3 de gas, m 3 | 23,80 | 30,94 | 14,70 |
| Coeficiente de expansión volumétrica de la fracción líquida, % por 1°C | 0,003 | 0,002 | – |
| Punto de ebullición a una presión de 1 bar, °C | -42,1 | -0,5 | +98...104 (50% puntos) |