Физические свойства углеводородов
3. Нефть и газ- основное энергетическое сырье
3.1. Химический состав нефти
Нефть является смесью большого числа различных углеводороводов (УВ) парафинового (молекулярная формула С n H 2n+2), нафтенового и ароматического (С n H 2n-2,-4,-6) рядов. Содержание углерода колеблется в пределах 82÷87%, водорода 11÷14%. На долю этих двух компонентов приходится до 99% всего состава. Из УВ различного строения обычно преобладают УВ метанового (парафинового) ряда, реже нафтенового. Обычно в нормальных условиях (т.е. при давлении Р=0,1 МПа и температуре 0 0 С (273 0 К) () Нефть представляет собой маслянистую горючую жидкость обычно темно-коричневого цвета с зеленоватым оттенком. В природе встречаются нефти и более светлой окраски - светло-коричневые, красноватые, зеленые и даже бесцветные. Объяснение такому многообразию нефти можно найти в их исключительно сложном составе, хотя по элементарному составу все они довольно близки
Углеводороды от метана до бутана (СН 4 ÷С 4 Н 10) парафинового ряда при нормальных условиях, находятся в газообразном состоянии. Углеводороды, содержащие от 5 до 17 атомов углерода в молекуле (С 5 Н 12÷ С 17 Н 36), при нормальных условиях - жидкие вещества. Углеводороды, в молекуле которых имеется свыше 17 атомов углерода - твердые вещества. К ним относятся парафин и церезин.
В пластовых условиях нефть состоит из трех частей. На поверхности она теряет газ и частично парафин. Газ, выделившийся из нефти при добыче, принято называть попутным или нефтяным.
В зависимости от состава и некоторых свойств, проводится классификация нефти, что облегчает ее сортировку по качеству и выбор той или иной технологической схемы сбора. По содержанию парафина нефти подразделяют на:
· малопарафиновые (≤ 1,5%);
· парафиновые (1,5÷6%);
· высокопарафиновые (> 6%).
Иногда встречаются нефти с высоким содержанием парафина (до 30%), например, нефти месторождений Узень и Жетыбай. В нормальных условиях это твердые вещества. Нефти северных месторождений Тюменской области содержат до 20% парафина.
Сернистые соединения считаются, как правило, вредными примесями нефти, так как или непосредственно корродируют металл, или в процессах переработки превращаются в корродирующие соединения. По содержанию серы нефти делятся на три класса:
· малосернистые (с содержанием серы до 0,5%);
· сернистые (0,5÷2%);
· высокосернистые (более 2%).
Сера может находиться в нефти и в свободном состоянии, и в виде органических соединений (сульфиды, меркаптаны и др.). Кислород чаще присутствует в виде нафтеновых и жирных кислот, а также асфальтенов. Кроме этих соединений нефти в очень небольших количествах содержат хлор, йод, фосфор, мышьяк, калий, натрий, азот и многие другие элементы таблицы Д.И. Менделеева, а также пластовую воду.
Известно, что чистые углеводороды без цвета и запаха. Цвет нефти, как считает часть специалистов, придает смола. Достаточно 0,1% ее, чтобы придать чистым углеводородам соломенно-желтый оттенок. Специфический запах нефти чаще всего придает сероводород (Н 2 S).
3.2. Физические свойства углеводородов
Физические свойства нефти и нефтяных газов, а также их качественная характеристика зависят от преобладания в них отдельных углеводородов или их различных групп (фракций). Физические свойства нефти определяются свойствами входящих в нее компонентами (табл. 2.6). Нефти, содержащие значительное количество тяжелых углеводородов, дают меньшие выходы бензиновых фракций и имеют большую плотность.
Таблица 2.6
Свойства компонентов, входящих в состав нефтяных газов и нефти
Под плотностью принято понимать отношение массы вещества при температуре 20 0 С к занимаемому объему. В системе СИ плотность измеряется в кг/м 3 , а удельный вес γ - в Н/м 3 . На практике также пользуются относительной плотностью , которая численно равна отношение плотности нефти к плотности дистиллированной воды при температуре 4 0 С. Обычно нефть легче воды, плотность ее составляет от 750÷950 кг/м 3 . Нефти, плотностью менее 900 кг/м 3 , принято называть легкими , а более 900 кг/м 3 - тяжелыми .
Следует отметить, что плотность нефти уменьшается с повышением температуры и увеличением содержания в ней газа. Таким образом, газонасыщенная пластовая нефть всегда имеет меньшую плотность, чем дегазированная, и разница тем больше, чем больше извлечено газа. Для определения плотности используют ареометры (денсиметры), пикнометры и специальные приборы (весы Вестфаля и др.).
Одним из основных физических свойств нефти, имеющем большое значение при проектировании и эксплуатации транспортных систем, является вязкость. Под вязкостью принято понимать свойство нефти оказывать сопротивление перемещению частиц относительно друг друга, т.е. характеризует подвижность жидкости.
Различают вязкость динамическую µ , измеряемую в [Па·с] и вязкость кинематическую ν , [м 2 /с]. Вязкость нефти обычно ниже 1Па·с, поэтому в практике часто пользуются дробными единицами, например МПа·с, или внесистемной единицей вязкости, называемой Стоксом (1Ст=10 -4 м 2 /с). Кинематическую вязкость можно определить через отношение динамической вязкости нефти к ее плотности, т.е. ν=μ/ρ.
С повышением температуры вязкость нефти уменьшается, а с повышением давления, наоборот, увеличивается. Высокомолекулярные углеводороды повышают значение вязкости, поэтому вязкость легких нефтей меньше, чем тяжелых. Вязкость пластовой нефти может быть существенно меньше вязкости дегазированной. Например, эта разница у Ромашкинской нефти составляет до 600%.
Для измерения вязкости нефти применяют специальные приборы - вискозимеры капиллярного и ротационного типов. В первом случае вязкость определяется как отношение времени истечения через калибровочное отверстие исследуемой нефти ко времени истечения воды. Вискозиметры ротационных типов основаны на измерении сопротивления при относительном вращении двух коаксиальных цилиндров, зазор между которыми заполняется исследуемой нефтью.
В пластовых условиях в нефти всегда растворено какое-то количество газа, иногда даже до 1000 м 3 /т (в среднем около 100 м 3 /т). Способность газа растворяться в нефти характеризуется величиной коэффициента растворимости или газовым фактором, под которым понимают количество газа (растворенное или выделенное), приведенное к атмосферному давлению, приходящееся на 1 т нефти.
Компоненты нефтяного газа обладают различной растворимостью в нефти. С увеличением молекулярного веса коэффициент растворимости газов возрастает. Так, растворимость этана почти в 5 раз больше, чем метана, а пропана - более чем в 20 раз. С повышением температуры растворимость уменьшается.
На практике чаще сталкиваются не с растворимостью газов, а с обратным явлением - выделением газа из нефти. Давление, при котором начинают выделяться первые пузырьки растворенного газа, называют давлением насыщения Р н . Давление насыщения характеризует термодинамическое равновесие газа с пластовой нефтью. Нефть, находящаяся в пласте при давлении выше давления насыщения, обычно называют недонасыщенной. Давление Р н зависит как от углеводородных газов, так и неуглеводородных, например, азота, обладающего наиболее низкой растворимостью в нефти. В случае, когда давление в пласте ниже Р н, газ не весь будет растворен в нефти и часть его займет возвышенные участки пласта, образуя газовую шапку.
Выделение растворенного газа из нефти происходит также при движении ее по стволу скважины, в нефтегазосборных трубопроводах и окончательно завершается на концевых ступенях сепарации после подготовки товарной нефти.
Давление насыщения не следует отождествлять с давлением насыщенных паров товарной нефти, при котором газовая и жидкая фазы нефти находятся в термодинамическом равновесии при фиксированном отношении фаз. Обычно это давление не превышает 500 мм рт.ст.
3.3. Фазовые состояния углеводородных систем при изменении давления и температуры
Отдельные газы или многокомпонентные системы могут находиться в одно-, двух- и трехфазном состоянии (газообразном, жидком или твердом). Индивидуальные газы изменяют свой объем в зависимости от давления и температуры. Если вещество находится в однофазном состоянии, то его объем V определяют по температуре Т и давлению Р.
При изотермическом сжатии метана его объем уменьшается с повышением давления до появления жидкой фазы (кривая Е). Затем сжатие метана происходит при постоянном давлении до его полного перехода в жидкое состояние, после чего дальнейшее сжатие приводит к резкому возрастанию давления (ba). Температура, при которой с повышением давления в газе появляется первая капля жидкости, называется точкой росы или точкой конденсации (точка d). Температура, при которой происходит полный переход газа в жидкость, называется точкой насыщения (точка b). Линия b - линия равновесного сосуществования газовой и жидкой фаз, называют линией упругости паров, а соответствующее давление - давлением упругости паров.
Для однокомпонентных систем точка росы, точка насыщения, упругость паров соответствуют одному и тому же давлению и температуре, поэтому линия параллельна оси удельного объема. Из этого рисунка следует, что линия bc есть геометрическое место точек насыщения, а линия cde - геометрическое место точек росы. Точка С, в которой встречаются эти линии, называется критической. В этой точке различие между газообразной и жидкой фазами исчезает. Критической точке С соответствуют критические давление и температура.
Таким образом, максимальная температура, при которой данный газ еще может быть переведен в жидкое состояние, называется критической температурой, а соответствующее ей давление называется критическим давлением. Критическая температура метана равна -82,1 0 С, для этана - +32,3 0 С, для азота - +141,7 0 С. Внутри области bcde имеем сосуществующие газообразную и жидкую фазы. Правее линии cde - газообразная фаза, левее линии bc - жидкая фаза.
Фазовое поведение двух- и многокомпонентных систем зависит не только от давления и температуры, но и от состава газа.
3.4. Состав и физические свойства природных газов
Месторождения природного газа в зависимости от состава пластовой продукции условно делятся на газовые и газоконденсатные.
Газовые - это месторождения, продукция которых не нуждается в дополнительной обработке перед подачей в магистральные газопроводы. Подготовка в этом случае заключается только в извлечении влаги из газа, а в случае необходимости и кислых компонентов.
Газоконденсатные - это такие месторождения, продукция которых должна подвергаться обработке для извлечения из них пентана и высших углеводородов. Это влияет как на схему обработки пластовой продукции, так и на технико-экономические показатели эксплуатации месторождения.
Свойства газа определяются свойствами отдельных компонентов, входящих в его состав (табл. 2.7).
Основной компонент природных газов - метан (до 98%). В составе природных газов в значительном количестве содержатся также этан, пропан, бутан, пентан и более тяжелые углеводороды. В состав газов всегда входят водяные пары и довольно часто такие компоненты, как азот, сероводород, двуокись углерода и гелий.
Таблица 2.7
Основные физико-химические свойства компонентов, входящих в состав сжиженных газов при температуре 0 0 С и давлении 0,1013 МПа


В составе природных газов и газового конденсата (табл. 2.8) наряду с сероводородом встречаются и другие сернистые соединения, которые разделяются на две группы - активные и неактивные. К активным сернистым соединениям относятся сероводород, элементарная сера, сернистый ангидрид, меркаптаны и т.п. К неактивным соединениям серы - сульфиды, дисульфиды, тиофен и тиофаны. Из сернистых соединений газа наиболее активен сероводород, он вызывает коррозию металлов с образованием сульфидов. Наличие влаги в газе резко усиливает коррозионное действие сероводорода и других кислых компонентов.
Таблица 2.8
Состав газовых конденсатов некоторых месторождений

Метан при обычных условиях (при Р=0,1 МПа и Т=20 0 С) ведет себя как реальный газ. Этан находится на грани газа и пара. Пропан и бутаны при обычных условиях являются газами, так как их критические параметры весьма высоки.
Углеводороды, начиная с изопентана и выше, при обычных условиях (0,1 МПа и 0 0 С) находятся в жидком состоянии, а в составе газа - в капельном виде. В составе газов чисто газовых месторождений значительно больше содержится метана, чем в составе нефтяных газов.
В зависимости от преобладания легких (СН 4 , С 2 Н 8) или тяжелых (С 3 Н 8+в) компонентов газ разделяется соответственно на две группы: сухой и жирный. В сухом газе содержание тяжелых углеводородов незначительное или они отсутствуют, в то время как в жирном газе их количество может достигать таких величин, что из него можно получать сжиженные газы или конденсат (газовый бензин). На практике принимают сухим газ, содержащий в 1м 3 менее 60 г газового бензина, а жирным - более 60-70 г бензина.
3.5. Газогидраты
Обнаружили газогидраты совсем случайно. По всем расчётам геологов и мерзлотоведов, в недрах должен был залегать газ. Но когда пробурили скважину, его там не оказалось. Приборы обнаружили, что в глубинах залегают какие-то лёгкие пористые породы. Взяли пробу из скважины, принесли её в тёплое помещение, и тут... раздался взрыв.
Открытие газогидратов сейчас называют чуть ли не революцией в энергетике. Их запасы просто невероятны - они залегают под третью поверхности суши и почти под всей поверхностью Мирового океана. По предварительным подсчётам, это просто сверхгигантское газовое месторождение. В России газогидратные месторождения занимают площадь 2,4 млн. км 2 , главным образом на северо-западе европейской части России, в Сибири и на Дальнем Востоке.
Газогидраты внешне выглядят как белесые кристаллы. По существу, это замёрзшая вода, вобравшая в себя огромное количество углеводородов. Их энергетическая ёмкость довольно высока - один кубический метр кристаллогидрата включает до 200 м 3 горючего газа, например - метана.
На суше запасы газогидратных месторождений уступают обычным газовым. А в морских осадках и в подстилающих породах уже на глубине десятков и первых сотен метров их ресурсы легко доступны. Извлекать морские газогидраты предлагается посредством подъёма пульпы при её последующей дегазации. Для этого потребуются макроплатформы и специальные суда, оснащённые трубопроводами.
Чтобы знать, где искать газогидраты, нужно понимать, как они образовались. Выяснилось, что эти загадочные невидимки - горючие газы, например, тот же метан, - залегают на несколько десятков метров ниже раздела «лёд - фирн». Вода при замерзании захватывает воздух и он в теле льда погружается, или, как говорят гляциологи, растекается от центра к периферии вместе с ледниковыми слоями. А под большим давлением, при отрицательных температурах и с помощью движущей силы поляризации эти флюиды уже превращаются в гидраты. В Антарктиде такое превращение происходит на глубинах свыше 700 метров, а в Гренландии - с 900 метров. Так, в толщах льда и даже подстилающих его породах накапливаются летучие, но замёрзшие и отвердевшие вещества. И они перемещаются в соответствии с наступлением или отступанием ледника. При изменении объёмов льда, а значит и давления, флюиды могут смещаться и по вертикали. Перспективными при разведке газогидратов оцениваются краевые зоны ледников, в которые выдавливались эти углеводороды.
После обнаружения газогидратов в ледяных и мёрзлых толщах и уяснении их огромной энергетической ценности, промёрзшие породы стали называть «золотой жилой». Но оказалось, что это не только образное сравнение, а вполне реальный феномен. В условиях вечной мерзлоты, выступая то в качестве окислителей, то в качестве восстановителей, накапливаются различные вещества. Даже такой инертный металл как золото может накапливаться в толще льда. При плавлении «жильного льда», образующегося при замерзании воды в трещинах мёрзлого грунта, глазам исследователей на Севере нередко представали ажурные конструкции из нитей и плёнок золота. Минеральный «скелет» может содержать и другие полезные ископаемые. Их поиск и разведка залежей, наравне с углеводородами, относится к заботам уже не молодой науки – геохимии криолитозоны.
3.6 . Требования к качеству товарного газа
Показатели качества товарного газа основаны на следующих требованиях:
1.Газ при транспортировке не должен вызывать коррозию трубопровода, арматуры, приборов и т.д.;
2.Качество газа должно обеспечить его транспортировку в однофазном состоянии, т.е. не должно произойти образование и выпадение в газопроводе углеводородной жидкости, водяного конденсата и газовых гидратов;
3.Товарный газ не должен вызывать осложнений у потребителя при его использовании.
Для того, чтобы газ отвечал указанным требованиям, необходимо определять точку росы по воде, содержание углеводорода, содержания в газе сернистых соединений, механических примесей и кислорода.
Важный показатель качества товарного газа - содержание в нем кислорода. Значение этого показателя - не более 1%. При большем содержании кислорода газ становится взрывоопасным. Кроме того, кислород способствует усилению коррозии в системе.
Отраслевой стандарт не устанавливает конкретное содержание отдельных углеводородов в товарном газе. Это связано с разнообразием составов сырьевого газа (табл. 2.9).
Таблица 2.9
Нормы ГОСТ 51.40-93 на природный газ, транспортируемый по магистральным газопроводам

В ГОСТ 51.40-93 введен новый показатель, ограничивающий содержание меркаптановой серы в товарном газе, не более 36 мг/м 3 .
В газе могут содержаться также сероокись углерода (COS), сероуглерод (CS 2) и др. В ГОСТе содержание этих компонентов не указано. Следовало бы установить общее количество всех сернистых соединений в газе.
Несомненно, обеспечение надежной транспортировки, хранения и использования продукции газовой промышленности должно отвечать определенным требованиям, изложенным в соответствующих стандартах и технических условиях.
Например, на заключительном этапе разработки газоконденсатных месторождений для получения товарного газа, отвечающего требованиям отраслевого стандарта, необходимо вводить установки искусственного холода (УИХ). Затраты на строительство и эксплуатацию УИХ значительно превышают прибыль от выхода дополнительной продукции УКПГ. Для поддержания высокой эффективности работы газотранспортных систем предложен комплексный подход к определению показателей качества газа. Суть предложения сводится к тому, чтобы не внедрять ГОСТ на каждом месторождении, связанном с одним магистральным газопроводом, а на основном месторождении установить более высокие показатели качества газа, чем по стандарту. За основное можно принимать наиболее крупное месторождение из рассматриваемой группы с тем, чтобы на нем было экономически выгодно применять сложную технологию, позволяющую на всех этапах разработки осуществлять осушку газа по влаге и извлечению тяжелых УВ.
Базовыми могут служить месторождения, в газе которых содержится сероводород, т.к. на газоперерабатывающих заводах после сероочистки необходимо проводить осушку на гликолевых установках или охлаждать весь объем газа с использованием искусственного холода.
Практически без больших дополнительных затрат на базовых месторождениях или на газоперерабатывающих заводах можно готовить газ с точкой росы по влаге и углеводородам ниже, чем по ГОСТ 51.40-83. Это позволит подавать в магистральный газопровод газ, добываемый на небольших месторождениях, находящихся вдоль трассы, без организации сложных систем промысловой подготовки газа, осуществляя только отделение жидкой фазы. Смешение сырого газа с газом, имеющим более низкую точку росы, чем по требованиям ГОСТа, позволяет получить смесь, которая будет отвечать требованиям ГОСТа.
Применение такой системы промысловой подготовки газа дает возможность сконцентрировать сложное промысловое оборудование на одном базовом месторождении, мелкие месторождения обустраивать по упрощенным схемам.
Основные требования к технологическим процессам промысловой и заводской обработки природных и нефтяных газов - это обеспечение показателей качества товарного газа и другой продукции газовой промышленности.
Следует отметить, что в настоящее время единых международных норм по допустимым содержаниям сероводорода, углекислоты, сероорганических соединений, азота, воды, механических примесей и т.д. не существует.
3.7. Теплотехнические свойства нефтепродуктов и газа
Теплота испарения - количество тепла, расходуемое на превращение в пар одного килограмма жидкости при температуре ее кипения (ее называют еще скрытой теплотой, т.к. она расходуется не на повышение температуры продукта, а на его испарение).
Средние значения теплоты испарения (в кДж/кг): бензина - 293÷314; керосина - 230÷251; дизельных топлив - 209÷213; масел - 167÷209.
Теплоту испарения нефтяных фракций можно определить по следующей формуле:
l = 4,19∙(22T к /μ), кДж/кг
где μ - молекулярная масса;
Т k - средняя температура кипения, К.
Теплота конденсации - количество тепла, выделяющееся при конденсации пара в жидкость при той же температуре и численно равное скрытой теплоте испарения.
Теплота сгорания (теплотворная способность) - количество тепла, выделяемое при полном сгорании топлива, кДж/кг (нефть - 42∙10 3 , мазут - 41∙10 3 , уголь - 31∙10 3 , ацетилен - 49∙10 3 , спирт метиловый - 22∙10 3 , этан - 52∙10 3 , бутан - 57∙10 3).
Теплота плавления (скрытая) - количество тепла, поглощаемое 1 кг твердого тела, когда оно при температуре плавления превращается в жидкость.
Температура застывания - температура, при которой продукт теряет текучесть. С увеличением содержания в нефтепродукте тяжелых УВ температура застывания уменьшается. Данная характеристика является важным показателем для масел.
Температура кристаллизации - температура, при которой начинается выпадение УВ (в основном парафина), сопровождающееся помутнением нефтепродукта и изменением его вязкостных характеристик.
Зная последние две характеристики, можно правильнее выбрать способы хранения и транспортировки продуктов с низкой температурой застывания.
Температура кипения - температура, при которой происходит переход вещества из жидкого состояния в парообразное не только с поверхности вещества (как при испарении), а по всему объему.
Теплоемкость - количество тепла, которое необходимо затратить для нагрева 1 кг вещества на 1 0 С. В зависимости от того, к какому количеству продукта относится тепло, различают удельную (на единицу массы) и мольную (на один моль). Зная теплоемкость продукта, можно определить необходимое количество тепла на нагревание его до требуемой температуры. Теплоемкость увеличивается с повышением температуры и уменьшением плотности. В зависимости от условий, при которых происходит процесс для газов и паров различают теплоемкость при постоянном давлении (С p) и при постоянном объеме (С v). Различают также истинную теплоемкость (при данной температуре). Средневзвешенную теплоемкость смеси С см определяют по закону аддитивности.
Для бензинов теплоемкость изменяется от 1,93 до 2,21 кДж/кг∙К при изменении температуры с 0 0 С до 50 0 С. Для реактивного топлива - от 1,91 до 2,15 кДж/∙кгК. Для этана - 3,3, пропана - 2,2.
Влагосодержание природных газов. Природный газ в пластовых условиях насыщен парами воды, поскольку газоносные породы всегда содержат связанную, подошвенную или краевую воду. В процессе эксплуатации месторождений значения давлений и температур изменяются. При этом снижение температуры вызывает уменьшение количества водяных паров в газовой фазе, а снижение давления - увеличение их содержания. В самом пласте по мере разработки происходит увеличение влагосодержания газа, т.к. пластовое давление падает при изотермическом режиме. Влагосодержание природного газа - важнейший параметр, который определяет в значительной мере технологические режимы эксплуатации скважин газопромысловых сооружений.
Абсолютное влагосодержание W равно массе водяных паров в единице объема газовой смеси, приведенной к нормальным условиям (0 0 С и 0,1 МПа), и измеряется в г/м 3 или кг/1000м 3 .
Относительное влагосодержание W 0 - отношение фактического содержания паров воды в единице объема газовой смеси при данных давлении и температуре к его влагосодержанию, т.е. к количеству водяных паров, которые могли бы содержаться в том же объеме и при тех же условиях при полном насыщении. W 0 измеряется в долях единицы или %. Полное насыщение оценивается как 100%.
Кристаллогидраты природных газов . Многие компоненты природного газа (метан, этан, пропан, изобутан, углекислый газ, сероводород, азот) в соединении с водой образуют кристаллогидраты - твердые кристаллические соединения, существующие при высоких давлениях и положительных температурах. Они представляют собой физические соединения газа и воды (клатраты), образующиеся при внедрении молекул газа в пустоты кристаллических структур, составленных из молекул воды. Все газы, размер молекул которых находится в пределах (4÷6,9)∙10 -9 м, образуют гидраты.
Условия образования гидратов газа могут быть представлены равновесными кривыми гидратообразования в координатах температура – давление для различной плотности.
С увеличением давления и плотности газа температура гидратообразования возрастает. Область существования гидратов на этих графиках располагаются левее и выше кривых.
3.8. Опасные свойства природных газов и нефти
Опасными свойствами углеводородных газов являются их токсичность и способность к образованию взрывоопасных смесей с воздухом, воспламеняющихся от электрической искры, пламени и др.
С увеличением молекулярной массы предельных УВ их токсические свойства возрастают. Предельно допустимые концентрации для метана - 10 мг/дм 3 , а для гептана только 2 мг/дм 3 .
Санитарными нормами проектирования промышленных предприятий в рабочей зоне производственных помещений предусмотрена предельно допустимая концентрация (ПДК) углеводородов (паров бензина), равная 0,3 мг/дм 3 .
Из газовых компонентов природных и нефтяных газов особенно токсичен сероводород. Сероводород - бесцветный газ. Относительная плотность его по воздуху 1,19. Человек чувствует сероводород (запах тухлых яиц) даже при содержании его в воздухе 0,0014÷0,0023 мг/дм 3 . Однако даже при непродолжительном пребывании человека в сероводородной среде его обоняние притупляется. Сероводород является ядом, вызывающим паралич органов дыхания и сердца (табл. 2.10).
Таблица 2.10
Предельно допустимая концентрация, мг/л
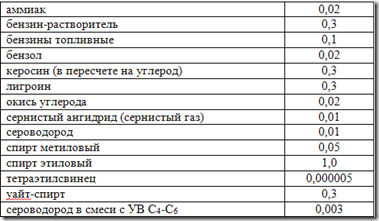
Природные нефтяные газы многих месторождений содержат в своем составе сероводород (Н 2 S) и двуокись углерода (СО 2). Объемное содержание этих компонентов, называемых иногда кислыми, колеблется в широких пределах, доходя до 50% и более. Значительное содержание Н 2 S и СО 2 обнаружено в газах глубоко залегающих месторождений Прикаспийской впадины, и, в особенности, Оренбургском, Карачаганакском, Астраханском. Содержание кислых компонентов в газе Астраханского месторождения достигает 40%, из которых концентрация сероводорода составляет 22%.
Воздействие газов на организм человека всегда отрицательно (табл. 2.11).
Таблица 2.11
Физиологическое воздействие газов на организм человека
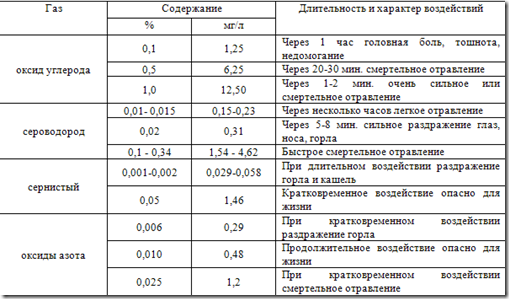
Концентрация сероводорода 0,006 мг/дм 3 при 4-часовом дыхании вызывает головную боль, слезотечение, светобоязнь, насморк. При концентрации около 0,2÷0,28 мг/дм 3 наблюдается жжение в глазах, светобоязнь, слезотечение, раздражение в носу и зеве, металлический привкус во рту, тошнота. Концентрация сероводорода 1 мг/дм 3 и выше приводит к острому отравлению (судороги, потеря сознания и быстро наступающая смерть). ПДК сероводорода в рабочей зоне производственных помещений - 0,01 мг/дм 3 .
Углекислый газ - бесцветный, практически без запаха. Общий характер действия на организм - наркотический и раздражающий кожу и слизистые оболочки. В высоких концентрациях вызывает быстрое удушье вследствие недостатка кислорода.
Сжиженный углеводородный газ (СУГ) представляет собой сложную смесь углеводородов, которые при нормальных условиях находятся в газообразном состоянии. Для комунально-бытовых нужд выпускаются и реализуются три его марки:
СПБТЗ – смесь пропана и бутана технических зимняя;
СПБТЛ – смесь пропана и бутана технических летняя;
БТ – бутан технический.
В состав СУГ входят углеводороды с количеством углеводородных атомов в молекуле С2-С5: этан, пропан, бутан и пентан.
Этан (С2Н6) – газ при нормальных условиях (температуре 273,16 К (0°С), давление 98066,5 Па) плотностью, равной 1,36 кг/м3. Этан добавляется в сжиженный газ в незначительных количествах, так как при 318 К (45 °С) он не может оставаться в сжиженном состоянии, а при 303 К (30 °С) давление его насыщенных паров достигает 4,8 МПа. Эти свойства следует учитывать, потому что стальные сварные баллоны для хранения сжиженного газа рассчитаны на рабочее давление 1,6 МПа, а подземные резервуары - 1 МПа.
Этан вводится в пропан с целью повышения общего давления насыщенных паров газовой смеси, для избежания понижения давления газа в зимнее время.
Углеводородные компоненты сжиженного газа.
Пропан (С3 Н8) - тяжелый газ, имеющий плотность при нормальных условиях, равную 2,02 кг/м3. Это один из основных компонентов сжиженного газа. Максимальная расчетная температура, при которой давление насыщенных паров пропана составляет 1,6 МПа, принимается равной 318 К (45 °С). Это соответствует требованием ГОСТ 15860-84 на стальные баллоны для сжиженных углеводородных газов. Давление паров пропана при температуре 238 К (-35 °С) составляет 0,14 МПа-наименьшее значение, при котором регулятор давления обеспечивает минимально допустимую производительность групповой установки. Поэтому пропан в сжиженном состоянии может быть использован в качестве топлива без искусственной регазификации три температуре до 243 К (-30 °С)
Паровая фаза технического пропана при температуре ниже 231 К (-42 °С) в газопроводе низкого давления конденсируется, что в конечном итоге может привести к прекращению газоснабжения.
Бутан (С4Н10) - тяжелый газ, имеющий два изомера: бутан и изобутан. Имея одинаковый химический состав и молекулярную массу, они отличаются расположением атомов в молекуле. Изомеры бутана представляют собой труднокипящие жидкости. Плотность паровой фазы технического бутана при нормальных условиях колеблется от 2,67 до 2,70 кг/м3 и начинает конденсироваться при температуре 272,5 К (-1 °С). В связи с этим сжиженный газ с повышенным содержанием бутана при использовании его для коммунально-бытовых целей в зимний период подлежит искусственной регазификации.
Технический бутан может быть использован при температуре атмосферного воздуха не ниже 278 К (5 °С). Увеличение количества бутана в сжиженном газе позволяет, не нарушая требования о предельном давлении насыщенных паров, повысить содержание в нем легких компонентов - метана, этана и этилена.
Пентан (С5 Н12) - тяжелый газ плотностью при нормальных условиях, равной 3,22 кг/м3. Наличие его в сжиженном газе резко снижает давление паров, повышает точку росы и увеличивает массу жидкого остатка. Температура конденсации пентана достигает 309 К (36 °С) Поэтому на газопроводах ГРУ, оборудованных испарителями, необходимо устанавливать конденсатосборники, конструкция которых должна обеспечивать удаление жидкого остатка.
При проектировании и эксплуатации установок сжиженного газа необходимо учитывать основные физико-химические характеристики не только отдельных углеводородных компонентов, но и их смесей: как давление насыщенных паров, плотность, критические параметры, коэффициент объемного расширения и сжатия, точка росы, удельная теплота фазового превращения, теплоемкость.
При стандартных условиях (Т = 298 К, Р = 1 атм) в зависимости от строения и молекулярной массы углеводороды могут быть газообразными, жидкими или твердыми веществами. Все углеводороды с длиной цепи С 1 – С 4 газообразны, С 5 – С 16 являются жидкостями. Углеводороды состава С 19 и выше – твердые вещества. Тип углеродной цепи влияет на температуры кипения (t 0 k) и плавления (t 0 пл). Так, нормальные углеводороды в отличие от разветвленных изомеров имеют более высокие t 0 k и t 0 пл. Пример:
СН 3 -СН 2 -СН 2 -СН 2 -СН 3 СН 3 -СН(СН 3)-СН 2 -СН 3
н-пентан изопентан (2-метилбутан)
t 0 k = +36 0 С, t 0 пл = -130 0 С t 0 k = +28 0 С, t 0 пл = -160 0 С
Между молекулами углеводородов в твердом и жидком состоянии действуют силы Ван-дер-Ваальса. Между ароматическими молекулами возникают силы - - электронного взаимодействия. Таким образом, силы сцепления между молекулами больше у нормальных углеродных цепей в жидких углеводородах, и отрыв молекулы от поверхности жидкости сложнее у н – цепей, чем у изомерных разветвленных. В твердых углеводородах фазовый переход твердое тело жидкость определяется плотностью упаковки молекул. Эта упаковка компактнее у неразветвленных углеводородов. Поэтому н – углеводороды плавятся при более высокой температуре, чем разветвленные. Рыхлость упаковки молекул разветвленных углеводородов в твердой фазе обусловливает более слабые силы межмолекулярного взаимодействия, более низкие энергии кристаллической решетки.
Введение одной двойной связи несколько понижает t 0 k (на 5-7 0) по сравнению с алканами. Зависимость t 0 пл более сложна.
Сопряженные алкадиены по t 0 k напоминают алканы, т. е. сопряжение не влияет на температуру кипения. Так, даже ароматическое сопряжение в бензоле (t 0 k = +80 0 С) не изменяет t 0 k (t 0 k циклогексана +81 0 С). С увеличением числа - связей и особенно в случае их сопряжения температуры плавления углеводородов заметно увеличиваются.
Н 2 С=СН-СН 2 -СН 3 Н 2 С=СН-СН=СН 2 НС С-С СН
1-бутен 1,3-бутадиен 1,3-бутадиин
t 0 пл = -185 0 С t 0 пл = -109 0 С t 0 пл = -36 0 С
Арены имеют в зависимости от типа более сложные зависимости t 0 k и t 0 пл. Среди дизамещенных бензола пара – изомеры всегда имеют более высокие t 0 пл (легче замерзают). Введение алкильной группы в бензол значительно повышает t 0 k (понижает летучесть) и сильно понижает t 0 пл.
Цвет, запах, действие на кожный покров.
Почти все углеводороды бесцветны за исключением длинноцепочечных сопряженных полиенов. Пример:
Н 2 С=СН-(СН=СН-СН=СН) n -СН=СН 2 , при n = 2 и более появляется окраска (ликопин или каротин томатов). Одноядерные ароматические углеводороды бесцветные соединения.
Запах органического соединения определяется его летучестью и характером взаимодействия с рецепторами органов обоняния. Газообразные углеводороды (метан, этан, пропан, бутан) не имеют запаха. Все газообразные непредельные углеводороды, начиная от очень слабо пахнущего этилена, имеют запах, усиливающийся с увеличением количества - связей и с их сопряжением. Ацетилен имеет слабый эфирный запах. Все жидкие углеводороды имеют запах керосина или бензина. Твердые углеводороды не пахнут при обычной температуре, если они не летучи.
Жидкие углеводороды раздражающим образом действуют на кожу.
Плотность, структурированность жидкого состояния.
Большинство углеводородов имеют плотность (объемную массу) меньше 1. Плотность углеводородов возрастает по мере увеличения молекулярной массы. Так, в ряду алканов от С 1 до С 30 плотность возрастает от 0,415 до 0,810, в ряду алкенов от С 3 до С 6 от 0,610 до 0,674, в ряду алкинов от С 3 до С 10 от 0,690 до 0,766. Это обусловлено возрастанием сил межмолекулярного взаимодействия за счет появления - связей.
В результате - -межмолекулярного взаимодействия арены заметно структурированы, в отличие от алканов, алкенов и алкинов. Поэтому их плотность значительно выше, чем у других углеводородов (для бензола d 4 20 = 0,879) и мало зависит от алкилирования.
Примечание: обозначение d 4 t означает, что плотность жидкости измерена при температуре относительно плотности воды при 4 0 С.
Растворимость в воде и неводных растворителях.
При растворении углеводородов в растворителях определяющей является сольватация их молекул, т. к. структурированность жидких и твердых углеводородов невелика. Под сольватацией следует понимать всю сумму энергетических и структурных изменений, происходящих в системе в процессе перехода газообразных молекул, ионов, радикалов или атомов в жидкую фазу растворителя с образованием однородного раствора, имеющего определенный химический состав и структуру. Сольватация малополярных органических молекул осуществляется благодаря диполь – дипольным и дисперсионным взаимодействиям. Углеводороды хорошо сольватируются неполярными жидкостями, их галогенопроизводными, но плохо сольватируются полярными жидкостями (водой, спиртами, карбоновыми кислотами). Чем выше полярность растворителя, тем ниже растворимость углеводородов. Поэтому все углеводороды неограниченно растворяются друг в друге и в галогенопроизводных (дихлорэтане, хлороформе, четыреххлористом углероде, хлористом метилене и т. д. В то же время они слабо растворяются в спиртах, кетонах, сложных эфирах и практически не растворяются в воде.
Горючесть, взрывоопасность, ядовитость.
Большинство углеводородов ядовито при хроническом вдыхании их паров. Особенно опасен бензол при длительной работе с ним, а также конденсированные арены с числом бензольных колец более 4. Последние способствуют развитию раковых заболеваний (канцерогенные вещества), поэтому попадание их в атмосферу и водоемы недопустимо
Все углеводороды горючи. При нагревании до 400-6000С без кислорода происходит обугливание, с кислородом – горение.
Физико – химические свойства и показатели пожарной опасности связаны между собой. Так, низкая температура кипения вещества указывает на низкую температуру вспышки данного вещества, а высокая химическая активность, особенно по отношению к окислителям, - на низкую температуру воспламенения.
Так, в ряду алканов с увеличением длины цепи повышается температура кипения, а следовательно, и температура вспышки. Повышается энтальпия сгорания, и понижается температура самовоспламенения.
При сгорании природного газа достигаются температуры до 1000 0 С и выше, а сжигание ацетилена в смеси с кислородом позволяет получать пламя с температурой до 2800 0 С. Это используется для резки и сварки металлов.
Представляет практический интерес расчет стандартных теплот сгорания углеводородов. Рассмотрим этот вопрос на примере алканов.
В общей формуле уравнение реакции горения алканов может быть записано следующим образом:
C n H 2n+2 + (3n+1)/2 O 2 = nCO 2 + (n+1)H 2 O
Cтандартная теплота сгорания с Н 298 может быть рассчитана по разности стандартных теплот образования продуктов реакции и реагентов:
с Н 298 = обр Н 298 (продукты) - обр Н 298 (реагенты).
Для расчета могут быть использованы величины обр Н 298 , приведенные, например, в “Справочнике химика”, 1966 г., Т. 1, стр. 774 – 837, 854 – 875. Ниже приводятся теплоты образования из С(тв), О 2 (газ), Н 2 (газ) газообразного СО 2 , жидкой воды (в кДж/моль).
СО 2 (газ) обр Н 298 = -393,3,
Н 2 О (ж) обр Н 298 = -285,8.
Теплоты образования органических соединений с хорошим приближением можно рассчитывать, пользуясь так называемыми инкрементами. При этом исходят из предположения о том, что каждая структурная единица вносит в теплоту образования всегда один и тот же вклад, независимо от того, в каком соединении эта единица находится (принцип аддитивности). Ниже приведена таблица 2 структурных инкрементов, достаточных для расчета теплот образования алканов.
Таблица 2
Величины структурных инкрементов
Расчет стандартной теплоты сгорания пропана.
СН 3 – СН 2 – СН 3 + 5О 2 3СО 2 + 4Н 2 О
Сумма теплот образования продуктов равна:
3(-393,3) + 4(-285,8) = -2323,1 кДж/моль
Сумма теплот образования реагентов:
(-42,34) 2 + (-20,63) = -105,31 кДж/моль
(Теплота образования О 2 (газ) из О 2 (газ) естественно равна нулю.
Разность дает стандартную теплоту сгорания пропана:
с Н 298 = -2323,1-(-105,3) = -2217,8 кДж/моль
При добыче угля в шахтах часто выделяется метан , образуя с воздухом взрывоопасные смеси. При взрыве метано-воздушных смесей развивается давление до 706 кПа. Поэтому там, где может выделяться природный газ, очень важно следить за составом воздуха. Для предупреждения взрыва при аварийном выделении метана и для тушения факела в закрытых объемах используют СО 2 или азот. Минимальная концентрация диоксида углерода как огнетушащего средства равна 26% (об.), азота 39% (об.). С хлором метан образует смесь, взрывающуюся при действии на нее солнечного света или другого сильного источника света. Взрыв смеси метана с хлором может произойти и при ее нагревании до 150 0 С. Поэтому недопустимо совместное хранение баллонов с хлором и метаном.
Представитель алкенов – этилен способен самовозгораться в атмосфере хлора. Эта реакция протекает со взрывом, особенно если на смесь попадает солнечный свет. Поэтому совместное хранение баллонов с хлором и этиленом недопустимо. В отличие от метана этилен горит сильно светящимся пламенем, что обусловлено повышенным содержанием углерода. Смесь этилена с воздухом при поджигании взрывается с большой силой. Давление при этом достигает 764 кПа. Минимальная концентрация диоксида углерода как огнетушащего средства в этом случае составляет 42% (об.), а азота 52% (об.). Эти концентрации намного выше, чем в случае метана, что объясняется более широким диапазоном пределов воспламенения этилена.
Ацетилен под давлением неустойчив. При давлении более 196 кПа ацетилен способен разлагаться со взрывом до углерода и водорода. Температура взрыва 3000 0 С, давление увеличивается приблизительно в 11 раз. Поэтому ацетилен нельзя хранить в сжатом состоянии, подобно другим газам, в стальных баллонах обычного типа. Для его хранения и перевозки применяют баллоны, наполненные активным углем, пропитанным ацетоном, в котором и растворяют ацетилен под давлением. При таком способе хранения ацетилен не взрывается даже при давлении 2940 кПа. Ацетилен с воздухом образует взрывчатые смеси. Пределы воспламенения: НПВ – 2% , ВПВ – 81%. Температура самовоспламенения 335 0 С. Ацетилено-воздушные смеси взрываются с большой силой. Давление взрыва достигает 931 кПа. Для предупреждения взрыва при аварийном выделении ацетилена и для тушения факела в закрытых помещениях требуется СО 2 57% (об.), а азота 70% (об.).
Нефть – источник углеводородов, легко воспламеняющаяся жидкость. Температура вспышки ее лежит в пределах от -34 0 С до +34 0 С. Нефть имеет сравнительно низкую температуру самовоспламенения, лежащую в пределах от 260 до 375 К. Кроме того она имеет высокую теплоту сгорания (выше 42000 кДж/кг). При перегонке нефти получают следующие фракции:
Газовая фракция содержит алканы С 1 – С 4 . Природный газ – это преимущественно метан ( 98%), баллонный газ – это в основном пропан и бутан.
Бензиновая фракция (t 0 k = 40 – 180 0 С) содержит углеводороды С 5 – С 12 , всего до 100 и более индивидуальных соединений, в том числе алканы, циклоалканы, алкилбензолы.
Керосиновая фракция (t 0 k = 180 – 300 0 С) содержит в основном углеводороды С 9 – С 16 . Это топливо для реактивных двигателе и сырье для крекинга.
Соляровый дистиллят (t 0 k = 300 – 400 0 С) состоит примущественно из углеводородов С 15 – С 25 . Это сырье для получения дизельного топлива.
Мазут (t 0 k = 300 0 С в вакууме) имеет приблизительный состав С 20 – С 30 . Используется как топливо для сжигания в топках котлов. Фракционной отгонкой под вакуумом получают смазочные масла, вазелин, парафин
Ароматический углеводород бензол – легковоспламеняющаяся жидкость, горит сильно коптящим пламенем. При взрыве паровоздушных смесей развивается давление до 784 кПа. Ароматические углеводороды тушат тонкораспыленной водой и пеной.
Большое преимущество пропан-бутановых смесей - их близость по основным характеристикам к традиционным моторным видам топлива. Именно это качество позволило им занять уверенные позиции на рынке.
Углеводороды, входящие в состав попутного нефтяного газа, при нормальных условиях находятся в газообразном состоянии, но при увеличении внешнего давления меняют свое агрегатное состояние и превращаются в жидкость. Это свойство позволяет добиться высокой энергетической плотности и хранить сжиженный углеводородный газ (СУГ) в сравнительно простых по конструкции резервуарах.
В отличие от попутного нефтяного газа, углеводороды, входящие в состав природного газа, при нормальных условиях находятся в газообразном состоянии и не меняют своего агрегатного состояния даже при значительном изменении давления. Поэтому хранение сжатого (компримированного) природного газа (КПГ) сопряжено со значительными сложностями - так, резервуар должен выдерживать значительное давление до 200 атмосфер.
Интенсивно продвигаются технологии получения и использования сжиженного природного газа (СПГ), который можно хранить в специальных изотермических сосудах при температуре ниже -160°С и давлении около 40 бар.
Во многом преимущества высокой энергетической плотности СПГ теряются из-за сложности криогенного оборудования, значительно более дорогого и требующего постоянного контроля высококвалифицированного персонала.
Производство СУГ
Основными компонентами сжиженного углеводородного газа являются пропан С 3 Н 8 и бутан С 4 Н 10 . Главным образом промышленное производство сжиженного газа осуществляется из следующих источников:
- попутные нефтяные газы;
- конденсатные фракции природного газа;
- газы процессов стабилизации нефти и конденсата;
- нефтезаводские газы, получаемые с установок переработки нефти.
Таблица 1. Физико-химические показатели сжиженного углеводородного газа по ГОСТ 27578-87
| Показатель | Марка ГСН | |
| ПА | ПБА | |
| Массовая доля компонентов, %: | ||
| метан и этан | Не нормируется | |
| пропан | 90±10 | 50±10 |
| углеводороды С 4 и выше | Не нормируется | |
| непредельные углеводороды, (не более) | 6 | 6 |
| Объем жидкого остатка при +40°С, % | Отсутствует | |
| Давление насыщенных паров, МПа: | ||
| при +45°С, не более | – | 1,6 |
| при -20°С, не менее | – | 0,07 |
| при -35°С, не менее | 0,07 | – |
| Массовая доля серы и сернистых соединений, %, не более | 0,01 | 0,01 |
| В том числе сероводорода, %, не более | 0,003 | 0,003 |
| Содержание свободной воды и щелочи | Отсутствует | |
Компонентный состав сжиженного газа регламентируется техническими нормами и . Первый стандарт описывает состав сжиженного газа, используемом в автомобильном транспорте. На сайте компании Техносоюз покрасочные камеры представлены в широком ассортименте, а так же различное оборудование для автосервиса. Зимой предписывается применять сжиженный газ марки ПА (пропан автомобильный), содержащий 85±10% пропана, летом?- ПБА (пропан-бутан автомобильный), содержащий 50±10% пропана, бутан и не более 6% непредельных углеводородов.
ГОСТ 20448-90 имеет более широкие допуски на содержание компонентов, в том числе вредных с точки зрения воздействия на газовую аппаратуру (например, серу и ее соединения, непредельные углеводороды и т.д.). По этим техническим условиям газовое топливо поступает двух марок: смесь пропан-бутановая зимняя (СПБТЗ) и смесь пропан-бутановая летняя (СПБТЛ).
Марка газа ПБА допускается к применению во всех климатических районах при температуре окружающего воздуха не ниже -20°С. Марка ПА используется в зимний период в тех климатических районах, где температура воздуха опускается ниже -20°С (рекомендуемый интервал - -25...-20°С). В весенний период времени для полной выработки запасов сжиженного газа марки ПА допускается его применение при температуре до 10°С.
Давление в баллоне
В закрытом резервуаре СУГ образует двухфазную систему. Давление в баллоне зависит от давления насыщенных паров (давления паров в замкнутом объеме в присутствии жидкой фазы) и характеризует испаряемость сжиженного газа, которая, в свою очередь, зависит от температуры жидкой фазы и процентного соотношения пропана и бутана в ней. Испаряемость пропана выше, чем бутана, поэтому и давление при отрицательных температурах у него выше.
Опыт многолетней практической эксплуатации показывает:
- при низких температурах окружающего воздуха эффективнее использовать СУГ с повышенным содержанием пропана, так как при этом обеспечивается надежное испарение газа, а следовательно, и стабильная подача продукта;
- при высоких положительных температурах окружающего воздуха эффективнее использовать СУГ с пониженным содержанием пропана, иначе в резервуаре и трубопроводах будет создаваться значительное избыточное давление, что может отрицательно повлиять на герметичность газовой системы.
Кроме пропана и бутана, в состав СУГ входит незначительное количество метана, этана и других углеводородов, которые могут изменять свойства смеси. Так, этан обладает повышенным, по сравнению с пропаном, давлением насыщенных паров, что может оказать отрицательное влияние при положительных температурах.
Изменение объема жидкой фазы при нагревании
Пропан-бутановая смесь обладает большим коэффициентом объемного расширения жидкой фазы, который для пропана составляет 0,003, а для бутана - 0,002 на 1°С повышения температуры газа. Для сравнения: коэффициент объемного расширения пропана в 15 раз, а бутана - в 10 раз, больше, чем у воды. Техническими нормативами и регламентами устанавливается, что cтепень заполнения резервуаров и баллонов зависит от марки газа и разности его температур во время заполнения и при последующем хранении. Для резервуаров, разность температур которых не превышает 40° С, степень заполнения принимается равной 85%, при большей разности температур степень заполнения должна снижаться. Баллоны заполняются по массе в соответствии с указаниями «Правил устройства и безопасной эксплуатации сосудов, работающих под давлением». Максимальная допустимая температура нагрева баллона не должна превышать 45°С, при этом упругость паров бутана достигает 0,385 МПа, а пропана - 1,4–1,5 МПа. Баллоны должны предохраняться от нагрева солнечными лучами или другими источниками тепла.
Изменение объема газа при испарении
При испарении 1 л сжиженного газа образуется около 250 л газообразного. Таким образом, даже незначительная утечка СУГ может быть очень опасной, так как объем газа при испарении увеличивается в 250 раз. Плотность газовой фазы в 1,5–2,0?раза больше плотности воздуха. Этим объясняется тот факт, что при утечках газ с трудом рассеивается в воздухе, особенно в закрытом помещении. Пары его могут накапливаться в естественных и искусственных углублениях, образуя взрывоопасную смесь.
Таблица 2. Физико-химические свойства составляющих сжиженного газа и бензина.
| Показатель | Пропан | Бутан (нормальный) | Бензин |
| Молекулярная масса | 44,10 | 58,12 | 114,20 |
| Плотность жидкой фазы при нормальных условиях, кг/м 3 | 510 | 580 | 720 |
| Плотность газовой фазы, кг/м 3: | |||
| при нормальных условиях | 2,019 | 2,703 | – |
| при температуре 15°С | 1,900 | 2,550 | – |
| Удельная теплота испарения, кДж/кг | 484,5 | 395,0 | 397,5 |
| Теплота сгорания низшая: | |||
| в жидком состоянии, МДж/л | 65,6 | 26,4 | 62,7 |
| в газообразном состоянии, МДж/кг | 45,9 | 45,4 | 48,7 |
| в газообразном состоянии, МДж/м 3 | 85,6 | 111,6 | 213,2 |
| Октановое число | 120 | 93 | 72-98 |
| Пределы воспламеняемости в смеси с воздухом при нормальных условиях, % | 2,1–9,5 | 1,5–8,5 | 1,0–6,0 |
| Температура самовоспламенения, °С | 466 | 405 | 255–370 |
| Теоретически необходимое для сгорания 1 м 3 газа количество воздуха, м 3 | 23,80 | 30,94 | 14,70 |
| Коэффициент объемного расширения жидкой фракции, % на 1°С | 0,003 | 0,002 | – |
| Температура кипения при давлении 1 бар, °С | -42,1 | -0,5 | +98...104 (50%-я точка) |