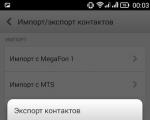
Ливе почта. С какими сервисами работает Windows Live Mail. Взаимодействие с Windows Live SkyDrive
Хром, переходный метал, который широко используется в промышленности благодаря своей прочности и устойчивости к нагреву и коррозии. Эта статья даст вам понимание некоторых важных свойств и возможностей использования этого переходного металла.
Хром относится к категории переходных металлов. Это твердый, но хрупкий металл серо-стального цвета с атомным номером 24. Этот блестящий металл помещают в группы 6 периодической таблицы, и обозначают символом «Cr».
Имя хромий является производным от греческого слова хрома, что означает цвет.
Верный своему имени, хром образует несколько интенсивно окрашенных соединений. Сегодня практически весь коммерчески используемый хром извлекается из руды хромита железа или окиси хрома (FeCr2O4).
Свойства хрома
- Хром является наиболее распространенным элементом на земной коре, но он никогда не происходит в чистом виде. В основном добывается из шахт, таких как хромитовые рудники.
- Расплавляют хром при температуре 2180 K или 3465°F, а температура кипения составляет 2944 K или 4840°F. его атомный вес 51.996 г/моль, и по шкале Мооса составляет 5,5.
- Хром встречается во многих окислительных состояниях, таких как +1, +2, +3, +4, +5, и +6, из которых +2, +3 и +6 являются наиболее распространенными, а +1, +4, А +5-это редкое окисление. В +3 степени окисления является наиболее стабильным состоянием хрома. Хром (III) может быть получен растворением элементарного хрома в соляной или серной кислоте.
- Этот металлический элемент известен своими уникальными магнитными свойствами. При комнатной температуре, он обладает антиферромагнитным упорядочением, которое показано на других металлах при относительно низких температурах.
- Антиферромагнетизм - это где соседние ионы, которые ведут себя как магниты присоединяются к противоположным или антипараллельным механизмам через материал. В результате, магнитное поле, создаваемое магнитными атомами или ионами, ориентируются в одном направлении отменяя магнитные атомы или ионы, выстроенные в противоположном направлении, так, что материал не проявляет никаких грубых внешних магнитных полей.
- При температуре выше 38°C, хром становится парамагнетиком, т. е. его привлекает внешне приложенное магнитное поле. Другими словами, хром привлекает внешнее магнитное поле при температуре выше 38°С.
- Хром не подвергается водородному охрупчиванию, т. е. не становятся хрупкими при воздействии атомарного водорода. Но при воздействии азота, он теряет свою пластичность и становится хрупким.
- Хром обладает высокой устойчивостью к коррозии. Тонкая защитная оксидная пленка образуется на поверхности металла, когда он вступает в контакт с кислородом в воздухе. Этот слой препятствует диффузии кислорода в основной материал и таким образом, защищает его от дальнейшей коррозии. Этот процесс называется пассивация, пассивация хромом дает устойчивость к воздействию кислот.
- Существует три основных изотопа хрома, которые называются 52Cr, 53Cr, 54Cr и, из которых 52 CR является наиболее распространенным изотопом. Хром реагирует с большинством кислот, но не взаимодействует с водой. При комнатной температуре он реагирует с кислородом, образуя оксид хрома.

Применение
Производство нержавеющей стали
Хром нашел широкий спектр применения благодаря своей твердости и устойчивости к коррозии. Он используется в основном в трех отраслях промышленности ― металлургической, химической и огнеупорной. Он широко используется для производства нержавеющей стали, так как это предотвращает коррозию. Сегодня это очень важный легирующий материал для сталей. Он также используется для изготовления нихрена, что используется в нагревательных элементах сопротивления из-за его способности выдерживать высокие температуры.
Покрытие поверхностей
Кислый хромат или дихромат используется также для покрытия поверхностей. Обычно это делается с помощью метода гальваники, в котором тонкий слой хрома наносится на металлическую поверхность. Другой способ - это хромирование деталей , через который хроматы используются для нанесения защитного слоя на определенные металлы, такие как алюминий (Al), кадмий (CD), цинк (Zn), серебро, а также магний (MG).
Сохранение древесины и дубление кож
Соли хрома (VI) являются токсичными, поэтому они используются для сохранения древесины от повреждения и разрушения грибком, насекомыми и термитами. Хром (III), особенно хромовые квасцы или сульфат калия используется в кожевенной промышленности, так как он помогает стабилизировать кожу.
Красители и пигменты
Хром также используется для изготовления пигментов или красителей. Желтый хром и хромат свинца, широко использовались в качестве пигмента в прошлом. Из-за экологических проблем, его использование существенно снизилось, а затем, наконец, его заменили свинец и хромовые пигменты. Другие пигменты на основе хрома, красного хрома, оксида зеленого хрома, которые является смесью желтой и Берлинской лазури. Окись хрома используется для придания зеленоватого цвета стекла.
Синтез искусственных рубинов
Изумруды обязаны своим зеленым оттенком хрому. Окись хрома применяется также для производства синтетических рубинов. Естественные рубины корунды или кристаллы оксида алюминия, которые обретают красный оттенок из-за присутствия хрома. Синтетические или искусственные рубины сделаны легированием хрома (III) на синтетических кристаллах корунда.
Биологические функции
Хрома (III) или трехвалентный хром, необходим в организме человека, но в очень небольших количествах. Это, как полагают, играет важную роль в липиде и метаболизме сахара. В настоящее время он используется во многих диетических добавках, которые как утверждают, имеют несколько преимуществ для здоровья, однако, это является спорным вопросом. Биологическая роль хрома не была должным образом проверена, и многие эксперты считают, что это не важно для млекопитающих, в то время как другие рассматривают его как важнейший микроэлемент для человека.
Другое использование
Высокая температура плавления и теплостойкость сделать хром идеальным огнеупорным материалом. Он нашел себе применение в доменных печах, цементных печах, и металлических. Многие соединения хрома применяются в качестве катализаторов для переработки углеводородов. Хром (IV) используется, чтобы произвести магнитные ленты, используемые в аудио и видеокассетах.
Шестивалентный хром или хром (VI) называется токсическим и мутагенным веществом, а хром (IV) является известным своими канцерогенными свойствами. Хромат соли также вызывает аллергические реакции у некоторых людей. Благодаря заботе о здравоохранении и экологическим проблемам, некоторые ограничения были наложены на использование соединений хрома в различных частях мира.
Хром - химический элемент с атомным номером 24. Это твердый, блестящий, серо-стального цвета металл, который хорошо полируется и не тускнеет. Используется в сплавах, таких как нержавеющая сталь, и в качестве покрытия. Организму человека требуются небольшие количества трехвалентного хрома для метаболизма сахара, но Cr (VI) очень токсичен.
Различные соединения хрома, такие как окись хрома (III) и хромат свинца, ярко окрашены и используются в красках и пигментах. Красный цвет рубина обусловлен наличием этого химического элемента. Некоторые вещества, особенно и натрия, являются окислителями, используемыми для окисления органических соединений и (вместе с серной кислотой) для очистки лабораторной посуды. Кроме того, окись хрома (VI) применяется в производстве магнитной ленты.
Открытие и этимология
История открытия химического элемента хром такова. В 1761 году Иоганн Готлоб Леман нашел в Уральских горах оранжево-красный минерал и назвал его «сибирским красным свинцом». Хотя он ошибочно был идентифицирован как соединение свинца с селеном и железом, материал на самом деле являлся хроматом свинца с химической формулой PbCrO 4 . Сегодня он известен как минерал кроконт.
В 1770 году Петр Симон Паллас посетил то место, где Леман нашел красный свинцовый минерал, который имел очень полезные свойства пигмента в красках. Использование сибирского красного свинца в качестве краски получило быстрое развитие. Кроме того, ярко-желтый цвет из кроконта стал модным.
В 1797 году Николя-Луи Воклен получил образцы красной Путем смешивания кроконта с соляной кислотой он получил оксид CrO 3 . Хром как химический элемент был выделен в 1798 году. Воклен получил его при нагревании окисла с древесным углем. Он также смог обнаружить следы хрома в драгоценных камнях, таких как рубин и изумруд.
В 1800-х годах Cr в основном применялся в составе красок и кожевенных солей. Сегодня 85% металла используется в сплавах. Остальная часть применяется в химической промышленности, производстве огнеупорных материалов и литейной промышленности.
Произношение химического элемента хром соответствует греческому χρῶμα, что означает «цвет», из-за множества цветных соединений, которые из него можно получить.

Добыча и производство
Элемент производят из хромита (FeCr 2 O 4). Примерно половина этой руды в мире добывается в Южной Африке. Кроме того, Казахстан, Индия и Турция являются его крупными производителями. Разведанных месторождений хромита достаточно, но географически они сконцентрированы в Казахстане и на юге Африки.
Залежи самородного металлического хрома встречаются редко, но они есть. Например, его добывают на шахте «Удачная» в России. Она является богатой алмазами, и восстановительная среда помогла образоваться чистому хрому и алмазам.
Для промышленного производства металла хромитовые руды обрабатывают расплавленной щелочью (едким натром, NaOH). При этом образуется хромат натрия (Na 2 CrO 4), который восстанавливается углеродом до оксида Сг 2 O 3 . Металл получают при нагревании окисла в присутствии алюминия или кремния.
В 2000 году было добыто около 15 млн т хромитовой руды, которая была переработана в 4 млн т феррохрома, на 70% состоящего из сплава хрома с железом, приблизительная рыночная стоимость которых составила 2,5 млрд долларов США.

Основные характеристики
Характеристика химического элемента хрома обусловлена тем, что он является переходным металлом четвертого периода таблицы Менделеева и расположен между ванадием и марганцем. Входит в VI группу. Плавится при температуре 1907 °С. В присутствии кислорода хром быстро образует тонкий слой оксида, который защищает металл от дальнейшего взаимодействия с кислородом.
Как переходный элемент, он реагирует с веществами в различных соотношениях. Таким образом он образует соединения, в которых имеет различные степени окисления. Хром - химический элемент с основными состояниями +2, +3 и +6, из которых +3 является наиболее устойчивым. Кроме того, в редких случаях наблюдаются состояния +1, +4 и +5. Соединения хрома в степени окисления +6 представляют собой сильные окислители.
Какого цвета хром? Химический элемент придает рубиновый оттенок. Сг 2 O 3 , используемый для также применяется в качестве пигмента под названием «хромовая зелень». Его соли окрашивают стекло в изумрудно-зеленый цвет. Хром - химический элемент, присутствие которого делает рубин красным. Поэтому он используется в производстве синтетических рубинов.

Изотопы
Изотопы хрома обладают атомным весом от 43 до 67. Обычно данный химический элемент состоит из трех стабильных форм: 52 Cr, 53 Cr и 54 Cr. Из них наиболее распространен 52 Cr (83,8% всего природного хрома). Кроме того, описаны 19 радиоизотопов, из которых наиболее стабильным является 50 Cr с периодом полураспада, превышающим 1,8x10 17 лет. У 51 Cr период полураспада - 27,7 дней, а у всех остальных радиоактивных изотопов он не превышает 24 ч, причем у большинства из них он длится менее одной минуты. Элемент также имеет два метасостояния.
Изотопы хрома в земной коре, как правило, сопутствуют изотопам марганца, что находит применение в геологии. 53 Cr образуется при радиоактивном распаде 53 Mn. Соотношение изотопов Mn/Cr подкрепляет другие сведения о ранней истории Солнечной системы. Изменения в соотношениях 53 Cr/ 52 Cr и Mn/Cr из разных метеоритов доказывает то, что новых атомные ядра были созданы непосредственно перед формированием Солнечной системы.

Химический элемент хром: свойства, формула соединений
Оксид хрома (III) Сг 2 O 3 , также известный как полуторная окись, является одним из четырех окислов этого химического элемента. Его получают из хромита. Соединение зеленого цвета обычно называют «хромовой зеленью», когда используют в качестве пигмента для живописи по эмали и стеклу. Оксид может растворяться в кислотах, образуя соли, а в расплавленной щелочи - хромиты.
Бихромат калия
K 2 Cr 2 O 7 является мощным окислителем и ему отдается предпочтение в качестве средства для очистки лабораторной посуды от органики. Для этого используется его насыщенный раствор в Иногда, однако, его заменяют бихроматом натрия, исходя из более высокой растворимости последнего. Кроме того, он может регулировать процесс окисления органических соединений, преобразуя первичный спирт в альдегид, а затем в углекислоту.
Бихромат калия способен вызвать хромовый дерматит. Хром, вероятно, является причиной сенсибилизации, ведущей к развитию дерматита, особенно рук и предплечий, который носит хронический характер и трудно излечим. Как и другие соединения Cr (VI), бихромат калия канцерогенен. С ним нужно обращаться в перчатках и соответствующими средствами защиты.

Хромовая кислота
Соединение обладает гипотетической структурой H 2 CrO 4 . Ни хромовая, ни дихромовая кислоты не встречаются в природе, но их анионы находят в различных веществах. «Хромовая кислота», которую можно встретить в продаже, на самом деле является ее кислотным ангидридом - триоксидом CrO 3 .
Хромат свинца (II)
PbCrO 4 обладает ярко-желтой окраской и практически не растворим в воде. По этой причине он нашел применение в качестве красящего пигмента под названием «желтый крон».
Cr и пятивалентная связь
Хром отличается своей способностью образовывать пятивалентные связи. Соединение создается Cr (I) и углеводородным радикалом. Пятивалентная связь формируется между двумя атомами хрома. Его формула может быть записана как Ar-Cr-Cr-Ar, где Ar представляет собой специфическую ароматическую группу.

Применение
Хром - химический элемент, свойства которого обеспечили ему множество различных вариантов применения, некоторые из которых приведены ниже.
Металлам он придает устойчивость к коррозии и глянцевую поверхность. Поэтому хром входит в состав таких сплавов, как нержавеющая сталь, используемых, например, в столовых приборах. Он также применяется для нанесения хромированного покрытия.
Хром является катализатором различных реакций. Из него делают формы для обжига кирпича. Его солями дубят кожу. Бихромат калия применяют для окисления органических соединений, таких как спирты и альдегиды, а также для очистки лабораторной посуды. Он служит фиксирующим агентом для окрашивания ткани, а также используется в фотографии и фотопечати.
CrO 3 применяется для изготовления магнитных лент (например, для аудиозаписи), которые обладают лучшими характеристиками, чем пленки с оксидом железа.
Роль в биологии
Трехвалентный хром - химический элемент, необходимый для метаболизма сахара в организме человека. Напротив, шестивалентный Cr очень токсичен.
Меры предосторожности
Металлический хром и соединения Cr (III), как правило, не считаются опасными для здоровья, но вещества, содержащие Cr (VI), могут быть токсичными, если их принимать внутрь или вдыхать. Большинство таких веществ оказывают раздражающее действие на глаза, кожу и слизистые оболочки. При постоянном воздействии соединения хрома (VI) могут вызвать повреждение глаз, если их не лечить должным образом. Кроме того, это признанный канцероген. Смертельная доза данного химического элемента - около половины чайной ложки. Согласно рекомендациям Всемирной организации здравоохранения, предельно допустимая концентрация Cr (VI) в питьевой воде составляет 0,05 мг на литр.
Так как соединения хрома используются в красителях и для дубления кожи, они часто встречаются в почве и грунтовых водах заброшенных промышленных объектов, требующих экологической очистки и восстановления. Грунтовка, содержащая Cr (VI), до сих пор широко применяется в аэрокосмической промышленности и автомобилестроении.
Свойства элемента
Основные физические свойства хрома следующие:
- Атомное число: 24.
- Атомный вес: 51,996.
- Температура плавления: 1890 °C.
- Температура кипения: 2482 °C.
- Степень окисления: +2, +3, +6.
- Конфигурация электронов: 3d 5 4s 1 .
Часто можно встретить такое понятие, как «хромированная поверхность», а нержавеющая сталь знакома почти каждому жителю планеты. Что в них общего? Правильный ответ — хром. Давайте узнаем, что такое хром и где его применяют, каковы его свойства и роль в жизни человека.
Хром — твердый металл, который имеет голубовато-серый цвет. Находится в 6-й группе 4-го периода таблицы Менделеева. Имеет атомный номер 24 и обозначение Cr.
Физические свойства хрома
Температура плавления хрома составляет 2130 градусов по шкале Кельвина, а температура кипения - 2945 Кельвинов. Металл имеет кубическую кристаллическую решетку и твердость 5 по шкале Мооса. Хром является одним из наиболее твердых металлов (в чистом виде) и уступает по показателям только Урану, бериллию, иридию и вольфраму. Очищенный хром легко поддается механической обработке.
Химические свойства хрома
Хром имеет несколько степеней окисления, которые значительно влияют на его свойства и цвет.
- Степень окисления +2 - имеет голубой цвет, является очень хорошим восстановителем.
- Степень окисления +3 - амфотерный оксид зеленого или лилового цвета.
- Степень окисления +4 - очень редкое соединение, не образует солей и имеет обычный цвет - серебристый.
- Степень окисления +6 - очень сильный окислитель, гигроскопичен и очень ядовит. Хроматы данного оксида имеют желтый цвет, а дихроматы - оранжевый.
В виде простого вещества устойчив на воздухе. Не вступает в реакцию с серной и азотистой кислотами. При температуре более 2000 градусов Цельсия сгорает и образует зеленый оксид хрома.
Существуют соединения хрома с бором, углеродом, азотом и кремнием.
Применение хрома
- Хром применяется при создании нержавеющих сплавов. Всем нам известная нержавеющая сталь создается с применением хрома.
- Хром используется как гальваническое покрытие. Наверняка вы видели хромированные металлические поверхности. Их можно узнать по красивому зеркальному блеску. Хромированные изделия меньше подвержены атмосферной коррозии (не ржавеют).
- Различные сплавы хрома применяются для создания сопел авиационных и ракетных двигателей, а также для производства сопел плазмотронов.
- Из сплава хрома и никеля создают нагревательные элементы.
- Из соединений хрома делают различные красители, а также соединения для дубления кожи.
Если вас интересуют значения других терминов, посетите раздел
Хром играет решающую роль в регулировании уровня сахара в крови: он является составной частью так называемого фактора толерантности к глюкозе, который наряду с инсулином способствует тому, чтобы после приема пищи уровень сахара в крови поднимался не слишком быстро и не слишком быстро снова понижался.
У вас повышены показатели сахара в крови? У вас повышен уровень холестерина или у вас катаракта? Вы набираете в весе? Эти симптомы часто являются следствием недостатка хрома в организме.
Бесспорно, хром занимает центральное место в метаболизме сахара.
Хотя многие годы практики показывают, что ограничение потребления углеводов — это самый легкий, самый надежный способ общего оздоровления, позволяющий обойти болезнь стороной, лучшим средством для ее диетологического лечения является хром.
Для уменьшения резистентности к инсулину
При регулярном приеме этот микроэлемент оказывает значительное лечебное воздействие на целый спектр нарушений здоровья, которые вызывает или отягощает резистентность к инсулину — включая:
При избыточном весе
Помимо перехода на низкоуглеводную диету прием добавок с хромом — лучший способ, который надежно поможет вам избавиться от нежелательного жира. Как показали исследования, хром действует по нескольким направлениям:
- Уменьшая тягу к сахару, хром позволяет легче придерживаться низкоуглеводного режима питания.
- Даже без соблюдения минерал может увеличивать общую костно-мышечную массу тела, что, в свою очередь, ускоряет обмен веществ и сжигает лишний жир.
- Хром помогает предотвратить потерю мышечной ткани, если вы намеренно ограничиваете калорийность рациона.
- Минерал способствует сжиганию калорий в процессе упражнений, что еще более облегчает сбрасывание веса. Тренировки также повышают выброс хрома из организма, усиливая вашу потребность в приеме добавок.
Для снижения уровня холестерина
Включение хрома в программу питательных добавок помогает повысить в крови содержание ЛВП-холестерина, очищающего артерии, и одновременно понизить уровни ЛНП-холестерина и триглицеридов. Общая концентрация холестерина также уменьшается.
Как сообщают исследователи, это снижение оказывается еще более впечатляющим, когда к хрому добавляют небольшое количество (никотиновой кислоты).
Для облегчения головных болей и укрепления костей
Терапевтическая ценность хрома в других областях не так твердо установлена, как в случаях диабета, сердечно-сосудистых заболеваний и гипертонии, однако она может распространяться и на многие другие заболевания:
- Он может облегчать хронические головные боли и помогать лечению угревой сыпи , которая, по-видимому, отчасти обусловлена нарушением обмена инсулина.
- Хром укрепляет кости , повышая уровень дегидроэпиандростерона (ДГЭА), и потому он может входить в программу лечения остеопороза.
- И хотя мы не можем утверждать, что хром предотвращает глаукому, он может (вместе с ) сдерживать рост внутриглазного давления .
Последствия дефицита
Более 90% американцев, например, испытывают недостаток хрома. И как часто бывает, меньше всего его у тех, кто в нем больше всего нуждается. Недостаточность хрома имеет самоподдерживающийся характер. Когда в вашем организме мало этого микроэлемента, вас сильнее тянет на сладкое.

Но чем больше сахара вы едите, тем в большей степени истощаются запасы хрома . Учитывая, что в наши дни средний американец ежегодно потребляет около 150 фунтов (68 кг) сахара и кукурузного сиропа, неудивительно, что проблемы резистентности к инсулину и дефицита хрома стали столь распространенными.
Если у вас лишний вес, весьма вероятно, что вы резистентны к инсулину. Ожирение является как причиной, так и последствием этого нарушения обмена веществ. Нарушения обмена инсулина и ожирение — равные факторы риска сердечных заболеваний.
Нехватка хрома тоже повышает вероятность развития болезней сердца.
За исключением приема добавок, не существует достаточно хороших способов восстановления запасов хрома в организме.
Правда, грибы, ячмень и цельнозерновые продукты содержат этот микроэлемент, но только в том случае, если они выращены на богатой хромом почве. Морепродукты и мясо тоже считаются хорошими пищевыми источниками, но опять же животные должны быть откормлены на богатом хромом рационе.